题目内容
13.学习化学离不开实验.
(1)小明同学在家里利用替代品进行相关实验.如:配制较多溶液时用玻璃杯代替如图1所示的仪器中的烧杯(填仪器名称,下同);搅拌时用筷子代替玻璃棒
(2)①写出实验室制取二氧化碳的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑;
②小明同学选用片状的鸡蛋壳和醋(填一种厨房调味品)反应来制取二氧化碳,并利用矿泉水瓶、玻璃杯、橡皮塞、导管、止水夹等组装了如图2所示甲、乙气体发生装置.比较甲、乙装置,甲装置的优点是B(填序号)
A.反应过程中可以添加固体药品 B.可以控制反应的发生与停止
③选用甲装置可以进行的下列实验是A(填序号)
A.块状的胡萝卜(催化剂)与过氧化氢溶液制氧气
B.加热高锰酸钾固体制氧气
C.粉末状的二氧化锰与过氧化氢溶液制氧气
④用二氧化锰与过氧化氢溶液反应制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;用加热高锰酸钾固体制取氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.收集氧气常选用上述装置丙或戊(填编号);收集二氧化碳常选用装置丙(填编号).
分析 (1)据仪器的用途分析解答;
(2)①实验室制取二氧化碳用大理石和稀盐酸反应,据反应原理书写方程式;
②鸡蛋壳的主要成分是碳酸钙,可与酸反应生成二氧化碳,并结合装置特点分析其优越性;
③甲装置适用于块状固体和液体常温反应制取气体,据此判断;
④根据实验室中用高锰酸钾制取气体反应物生、成物及反应条件写出反应的化学方程式.
解答 解:(1)小明同学在家里利用替代品进行相关实验.如:配制较多溶液时用玻璃杯代替如图1所示的仪器中的 烧杯,搅拌时用筷子代替 玻璃棒,加速溶解;
(2)①实验室制取二氧化碳用大理石和稀盐酸反应,大理石主要成分碳酸钙和盐酸反应生成氯化钙、水和 二氧化碳,反应方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
②鸡蛋壳的主要成分是碳酸钙,可与酸反应生成二氧化碳,所以可用片状的鸡蛋壳和食醋反应来制取二氧化碳,比较甲、乙装置,甲装置,可知二者的区别在于甲中矿泉水瓶底部有孔,乙没有,将矿泉水瓶放入液体,固液接触产生气体,不需要气体时,将矿泉水瓶移出,反应停止,所以装置的优点是:可以控制反应的发生与停止;
③甲装置适用于块状固体和液体常温反应制取气体,BD需要加热,所以不可行,C粉末装的锌放入矿泉水瓶会漏出,不可行,故选用甲装置可以进行的实验是:块状的胡萝卜与过氧化氢溶液制氧气;
④实验室用过氧化氢溶液与二氧化锰制取氧气,属于固液在常温下反应制取气体,可选用装置B作发生装置,反应的方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;高锰酸钾在加热的条件下可以分解产生二氧化锰、锰酸钾和氧气;化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,而且不易溶于水,所以可用向上排空气法和排水法收集;二氧化碳密度大于空气的密度,易溶于水,可用向上排空气法收集.
故答案为:(1)烧杯;玻璃棒;
(2)①CaCO3+2HCl═CaCl2+H2O+CO2↑;②食醋;B;③A;④2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;丙或戊;丙.
点评 本题主要考查了学生对实验室制取二氧化碳的装置、性质、收集等知识的掌握和应用,难度不大,但要结合题意细心分析.

| A. |  种植花草树木 | B. |  随意排放废水 | C. |  分类回收垃圾 | D. |  公共自行车出行 |
| A. | 蜡烛在空气中燃烧生成二氧化碳和水 | |
| B. | 红磷在空气中燃烧产生大量的白烟 | |
| C. | 木炭在氧气中燃烧更旺,并发出白光 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射 |
| A. | 丙烯酰胺由碳、氢、氧三种元素组成 | |
| B. | 一个丙烯酰胺分子中含有10个原子 | |
| C. | 丙烯酰胺的相对分子质量为71g | |
| D. | 丙烯酰胺中碳、氢、氧三种元素的质量比为3:5:1 |

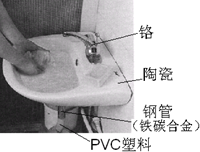 如图是家庭自来水池图片,请回答下列问题:
如图是家庭自来水池图片,请回答下列问题: .
.