题目内容
19. 在一次用餐中,同学们对燃料“固体酒精”产生了好奇,于是对其成分进行探究.
在一次用餐中,同学们对燃料“固体酒精”产生了好奇,于是对其成分进行探究.[查阅资料]
(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成的.
(2)氯化钙、氯化钡溶液均呈中性.
[提出问题]
(l)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
[实验探究]
(1)按右图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论.此结论合理(选填“合理”或“不合理”).
(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀.取沉淀于试管中加稀盐酸,有气泡产生.写出产生气体的化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
分析实验并结合资料得出氢氧化钠已变质.
(3)为进一步确定氢氧化钠的变质程度,分组探究.
①甲组取烧杯中上层清液于两支试管中,按下图探究.
| 方案 |  | 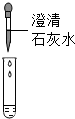 |
| 现象 | 溶液变红 | 产生 |
| 结论 | 清液有氢氧化钠 | 清液有碳酸钠 |
[实验结论]经讨论一致认为固体酒精中的氢氧化纳部分变质.
[反思交流]乙组实验中加足量氯化钡溶液的目的是除去碳酸钠,防止影响对NaOH的检验.
[拓展应用]要除去部分变质的氢氧化纳溶液中的杂质,可选择适量的AC(填序号).
A.Ba(OH)2溶液 B.BaCl2溶液 C.Ca(OH)2溶液.
分析 【实验探究】
(1)按右图实验,发现澄清石灰水变浑浊,说明酒精燃烧的产物中含有碳元素,根据质量守恒定律分析,可得出酒精中含有碳元素的结论;
(2)根据氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳分析;
(3)根据氢氧化钠溶液和碳酸钠溶液都显碱性,都能够使酚酞试液变红色分析;
【反思交流】
为了使碳酸钠完全反应,应该加入过量的氯化钡溶液;
【拓展应用】
碳酸钠能和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠分析.
解答 解:【实验探究】
(1)按右图实验,发现澄清石灰水变浑浊,说明酒精燃烧的产物中含有碳元素,根据质量守恒定律分析,可得出酒精中含有碳元素的结论,故填:合理.
(2)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,因此白色沉淀是碳酸钠和氯化钙反应生成的碳酸钙,碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O.
(3)乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由是:碳酸钠溶液显碱性,也能使酚酞试液变红色.
【反思交流】
乙组实验中加足量氯化钡溶液的目的是除去碳酸钠,防止影响对NaOH的检验.
【拓展应用】
要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的氢氧化钡溶液、氢氧化钙溶液,不能选择氯化钙溶液,因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,因此使用氯化钙时能够带入新杂质--氯化钠.故填:AC.
故答案为:
[实验探究]
(1)合理;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)Na2CO3溶液呈碱性,也能使酚酞变红;
[反思交流]除去溶液中的Na2CO3,排除其对NaOH检验的干扰;
[拓展应用]AC.
点评 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.

| A. | pH<0 | B. | 4.5<pH<6.5 | C. | 8<pH<10 | D. | pH>14 |