题目内容
3. 某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2.
某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2.(1)配制100g 10%稀盐酸需要37%浓盐酸(密度1.19g/cm3)的体积为22.7mL(结果保留小数点后一位).除了胶头滴管、烧杯外还需要的玻璃仪器是量筒、玻璃棒.
(2)6.5g粗锌完全反应共产生H2的质量为0.16g,则该粗锌中锌的质量分数为80%.
(3)验证后用装满水的10mL量筒代替小试管收集H2,装置如图所示.
①10mL量筒的最大刻度靠近N端.(填写“M”或“N”)
②当10mL量筒中的水全部被排尽后,实际收集到的H2体积V>10.0mL.(填写“>”、“=”或“<”)
分析 (1)据溶液稀释过程中溶质的质量始终不变以及所用仪器来分析;
(2)由氢气的质量根据锌与盐酸反应的化学方程式可以计算出所需锌的质量,进一步计算粗锌中锌的质量分数;
(3)根据量筒上的刻度来分析.
解答 解:(1)解:设需37%的盐酸的体积为x
100g×10%=37%×1.19g/cm3×x
x=22.7cm3=22.7mL
稀释过程中,除了胶头滴管、烧杯外还需要的玻璃仪器量筒、玻璃棒;
故答案为:22.7;量筒;玻璃棒;
(2)解:设所需锌的质量为y,则
Zn+2HCl=ZnCl2+H2↑
65 2
y 0.16g
$\frac{65}{2}=\frac{y}{0.16g}$
y=5.2g
则该粗锌中锌的质量分数为$\frac{5.2g}{6.5g}×100%$=80%
故答案为:80%;
(3)①量筒上的刻度由下到上是由小到大;故答案为:N;
②10mL量筒上10mL的刻度并不是在最上缘,也就是当10mL量筒中的水全部被排尽后,实际收集到的H2体积大于10.0mL;故答案为:>.
点评 本题主要考查溶液的稀释、学生利用化学方程式进行计算的能力.本题条件充足,步骤简单,学生应该容易解答.

练习册系列答案
相关题目
13. 某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示.下列说法错误的是( )
某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示.下列说法错误的是( )
 某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示.下列说法错误的是( )
某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示.下列说法错误的是( )| A. | a点溶液为酸性 | B. | b点恰好完全反应 | ||
| C. | c点溶液的溶质为硫酸 | D. | b、c两点沉淀质量相等 |
14.某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质,为了回收金属、保护环境,小科设计了如图方案(所加试剂均过量),下列判断正确的是( )
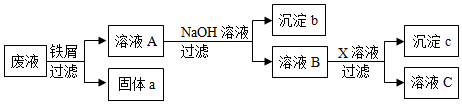

| A. | 固体a是铜 | |
| B. | X一定是Na2SO4 | |
| C. | 溶液B中含有的盐有Ba(NO3)2、NaNO3 | |
| D. | 若回收到6.4g固体a,则加入的铁屑质量为5.6g |
11.下列说法不正确的是( )
| A. | 多吃果蔬可以补充维生素 | |
| B. | 葡萄糖、淀粉、蛋白质都是有机高分子化合物 | |
| C. | 炒菜用加碘盐可补充碘元素 | |
| D. | CO与血红蛋白的结合能力强于O2 |
18.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了下图所示实验方案.

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 由实验甲可知金属活动性:Al>Cu | |
| B. | 由实验乙可知金属活动性:Cu>Ag | |
| C. | 由实验甲、乙、丙可知金属活动性:Al>Cu>Ag | |
| D. | 实验甲中的CuSO4改为CuCl2不能完成本实验探究 |
8.目前,湘潭市正在努力创建全国文明卫生城市.下列做法不符合这一主题的是( )
| A. | 城市道路定时洒水降尘 | B. | 公共场所禁止吸烟 | ||
| C. | 建筑工地加强扬尘控制 | D. | 垃圾露天焚烧处理 |
15.下列实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下列有关化学用语表示不正确的是( )
| A. | 2个铝离子:2Al3+ | B. | 钠原子的结构示意图: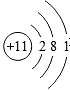 | ||
| C. | 氧分子:O | D. | 氧化镁中镁元素显+2价:$\stackrel{+2}{Mg}$O |
 现有A~G七种物质,已知A是赤铁矿的主要成分,G的浓溶液稀释时会放出大量的热,F溶液为蓝色,它们之间存在如图所示的转化关系:
现有A~G七种物质,已知A是赤铁矿的主要成分,G的浓溶液稀释时会放出大量的热,F溶液为蓝色,它们之间存在如图所示的转化关系: