题目内容
11. 化学兴趣小组对铁的性质做了如下探究:
化学兴趣小组对铁的性质做了如下探究:(1)如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片),①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果,乙同学不同意他的观点,认为还需要观察试管BC(选填试管编号),才能得出上述结论.
②试管AD的目的是探究铁在盐溶液中是否更容易锈蚀.
(2)小组同学思维拓展:向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等浓度的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱,有的同学认为这种方案不够合理,理由是金属与酸接触的面积不同,
(3)将过量的铁粉放入硝酸铜,硝酸锌的混合溶液中,充分反应后过滤,则反应后溶液质量比反应前减小(选填“增大”、“减小”或“不变”).
分析 根据已有的金属的锈蚀因素的实验探究以及金属活动性的知识进行分析解答即可.
解答 解:(1)(1)①要知道铁锈蚀的因素,必须设计对比试验,因此甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果的观点是不正确的,还需要观察试管BC,才能得出上述结论,故填:BC.
②探究铁在盐溶液中是否更容易锈蚀,则对比试管AD,故填:AD;
(2)由于金属铁是粉末,锌是粒状,与酸的接触面积不同,故这种方案不够合理,理由是金属与酸接触的面积不同,故填:金属与酸接触的面积不同;
(3)铁的活动性强于铜,弱与锌,故将过量的铁粉放入硝酸铜,硝酸锌的混合溶液中,铁与硝酸铜反应生成硝酸亚铁和铜,置换出的铜的质量大于生成的亚铁离子的质量,故充分反应后过滤,则反应后溶液质量比反应前减小,故填:减小.
点评 掌握金属的性质是正确解答本题的关键.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
14.世界上的物质多种多样,下列物质属于氧化物的是( )
| A. | 高锰酸钾 | B. | 液氧 | C. | 氯酸钾 | D. | 水 |
15.每年3月22日是世界水日,今年我国的活动主题是“节约保护水资源,大力建设生态文明”. 下列有关水的知识,其中正确的是( )
| A. | 自然界中的水中大多数为纯净物 | |
| B. | 农业上合理使用化肥和农药有利于水资源的保护 | |
| C. | 只有用蒸馏的方法才能降低水的硬度 | |
| D. | 我国可利用的淡水资源十分丰富 |
12.下列化学用语中,对“3”的含义表述不正确的是( )
| A. | Al3+-铝元素的化合价为+3 | |
| B. | 3H2O-3个水分子 | |
| C. | 3H-3个氢原子 | |
| D. | SO3-1个三氧化硫分子中含有3个氧原子 |
6.“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水、兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液PH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有CO2(或二氧化碳)生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
(3)根据如表数据,你认为上述制备反应的最佳温度范围是15~20℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
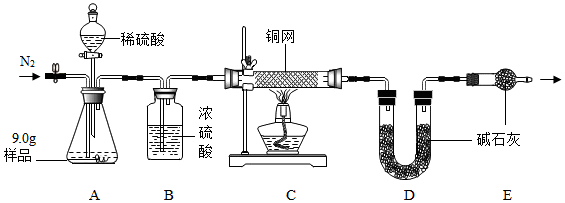
【组成测定】利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响)
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.②过碳酸钠能与酸反应放出CO2和O2.
(4)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是将生成的O2、CO2送入装置C、D,使其被完全使残留在装置中的气体全部被吸收.
(5)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(6)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%,属于合格品(填“一等品”“合格品”或“不合格品”);
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液PH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有CO2(或二氧化碳)生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
(3)根据如表数据,你认为上述制备反应的最佳温度范围是15~20℃.
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
【组成测定】利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响)
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.②过碳酸钠能与酸反应放出CO2和O2.
(4)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是将生成的O2、CO2送入装置C、D,使其被完全使残留在装置中的气体全部被吸收.
(5)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(6)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%,属于合格品(填“一等品”“合格品”或“不合格品”);




