题目内容
9.工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如图所示: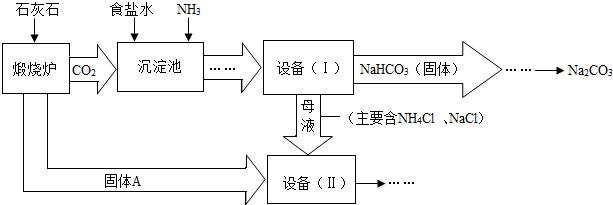
(已知2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作的名称是过滤.
(3)“沉淀池”中的反应是在加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,试分析该流程需要加压条件的原因是:增大二氧化碳的溶解度.
(4)“设备(Ⅱ)”中固体A与水反应的化学方程式是H2O+CaO=Ca(OH)2.
(5)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有NH3、NaCl(填写化学式).
(6)请写出一个该生产流程的优点:原料便宜易得(或者有物质可以循环利用).
分析 (1)根据碳酸钙高温分解的化学性质回答;
(2)根据过滤的原理和适用范围回答;
(3)根据影响气体溶解度的因素进行分析;
(4)根据反应物、生成物、反应条件,正确书写化学方程式;
(5)根据生产流程中有些物质可循环利用回答;
(6)根据生产过程中使用的原料成本,以及生产流程中有些物质可循环利用回答
解答 解:
(1)碳酸钙在高温下分解生成二氧化碳气体和氧化钙,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)过滤是把不溶于液体的固体和液体分开的一种分离混合物的方法,“设备(I)”中的液体混合物中分离出析出的晶体,故可用过滤的方法;
(3)影响气体溶解度的因素主要有:温度和压强,压强越大气体溶解度越大,加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,能增大二氧化碳的溶解度;
(4)氧化钙与水反应生成氢氧化钙,化学方程式为:H2O+CaO=Ca(OH)2;
(5)进入“设备(Ⅱ)”的物质有氧化钙、氯化钠、氯化铵及水,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物有氯化钠、氯化钙、氨气,其中氯化钠、氨气可再利用;
(6)从生产过程流程图可看出,使用的原料成本低、易得,且生产流程中有些物质可循环利用原料便宜易得(或者有物质可以循环利用)
故答案为:
(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)过滤;
(3)增大二氧化碳的溶解度;
(4)H2O+CaO=Ca(OH)2;
(5)NH3、NaCl;
(6)原料便宜易得(或者有物质可以循环利用).
点评 本题看起来起点很高,但落点较低,考查了学生对知识的理解和应用,也充分体现了化学来源于生产、生活,又服务于生产、生活的理念.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 氢氧化铝属于碱 | |
| B. | NaAlO2中铝元素的化合价为+3价 | |
| C. | 向氯化铝溶液中逐滴加入过量的氢氧化钠溶液,先产生白色沉淀,后沉淀不消失 | |
| D. | 向稀盐酸中加入氢氧化铝,发生中和反应 |
| A. | 石灰水 | B. | 盐酸 | C. | 水 | D. | 氯化钠溶液 |
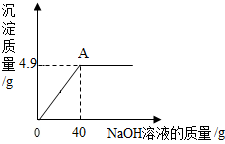 向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题:
向160g硫酸铜溶液中,逐滴加入40g NaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题:

