题目内容
6.计算题:(1)NaOH的摩尔质量为40g/mol,3mol NaOH中约含有1.806×1024个氧原子.
(2)将含0.1mol NaOH的溶液加入到100g的CuSO4溶液中,恰好完全反应.
①反应的化学方程式为2NaOH+CuSO4═Na2SO4+Cu(OH)2↓;
②生成的Cu(OH)2的物质的量为0.05mol,质量为4.9g.
分析 (1)摩尔质量是指单位物质的量的物质所具有的质量,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量.1mol任何物质中含有6.02×1023个分子.
(2)①氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,写出反应的化学方程式即可.
②由参加反应的氢氧化钠的物质的量,根据反应的化学方程式计算出生成氢氧化铜的物质的量即可.
解答 解:(1)摩尔质量是指单位物质的量的物质所具有的质量,氢氧化钠的相对分子质量是23+16+1=40,故氢氧化钠的摩尔质量是40g/mol.
1mol任何物质中含有6.02×1023个分子,一个氢氧化钠分子含有1个氧原子,故3molNaOH中约含有中有3mol×1×6.02×1023个=1.806×1024个氧原子.
(2)①氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
②设生成的氢氧化铜的物质的量为x
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
2 1
0.1mol x
$\frac{2}{1}=\frac{0.1mol}{x}$ x=0.05mol
质量为0.05mol×98g/mol=4.9g.
故答案为:(1)40g/mol;1.806×1024;(2)①2NaOH+CuSO4═Na2SO4+Cu(OH)2↓;②0.05;4.9.
点评 本题难度不大,掌握根据化学方程式的计算、化学式的有关计算是正确解答本题的关键.

练习册系列答案
相关题目
17.某物质具有如下性质,滴入无色酚酞变红,滴入氯化铜产生蓝色沉淀,加入碳酸钠溶液产生白色沉淀,则该物质是( )
| A. | KOH | B. | Mg(OH)2 | C. | CuSO4 | D. | Ca(OH)2 |
14.除去如表物质中所含少量杂质的方法,不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | H2 | HCl | 将气体通过NaOH溶液,干燥 |
| B | FeCl2 | CuCl2 | 加入过量的铁粉,过滤 |
| C | MnO2 | KCl | 加足量水溶解,过滤、洗涤,干燥 |
| D | CaO | CaCO3 | 加足量水溶解,过滤、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
16.将一定质量的铁粉和锌粉的混合物加入CuSO4溶液中,反应结束后过滤,滤液为无色,下列对滤液所含溶质和滤渣成分的判断中,正确的是( )
| A. | 滤液中一定含有ZnSO4 | B. | 滤渣中一定没有铁粉 | ||
| C. | 滤液中可能含有FeSO4 | D. | 滤渣中一定有锌粉 |
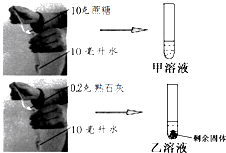 小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知:
小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知: