题目内容
18.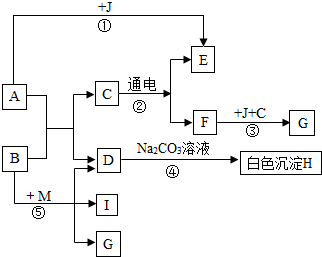 框图中A是人体胃液中含有的成分,B常用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•XH2O),E、F、I为无色气体.根据图示回答下列问题.
框图中A是人体胃液中含有的成分,B常用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•XH2O),E、F、I为无色气体.根据图示回答下列问题.(1)写出有关物质的化学式:
BCa(OH)2,CH2O,MNH4Cl.
(2)日常生活中为了阻止反应③发生,通常采用的措施是刷油漆(写一条).
(3)写出反应①④的化学反应方程式
①Fe+2HCl=FeCl2+H2↑,④CaCl2+Na2CO3=2NaOH+CaCO3↓.
分析 利用我们熟悉的一些物质的化学特性,找准切入点:物质A“人体胃液中含有的成分”为盐酸,物质B“改良酸性土壤”常用熟石灰,物质G是“铁锈的主要成分(Fe2O3•xH2O)”,而结合图框:物质C“通电条件下”反应生成气体的,我们初中阶段所学的只有水,这就是我们完成本题的突破口,利用这些知识点,我们可以完成该题.
解答 解:
根据反应条件“通电”,我们初步判断:C为水,那么E、F就是氧气和氢气,根据从F→G,由题给条件可知G为“铁锈的主要成分”,又因为铁是在有氧气和水的条件下生锈的,那么F就是氧气而J是铁,C为水,这也验证了我们最初的判断;
因为F是氧气,那么E就是氢气,我们已经知道J是铁了,那么A就是盐酸,与题给条件“人体胃液中含有的成分”吻合,B可以“改良酸性土壤”,我们初步判定它为氢氧化钙,氢氧化钙与盐酸反应生成氯化钙和水,C为水,那么D就是氯化钙,D可以与碳酸钠溶液反应生成白色沉淀H,这也进一步验证了B和D,那么H就是碳酸钙;
因为物质B“改良酸性土壤”常用熟石灰,B为氢氧化钙,根据题意我们知道B可以与M反应生成D氯化钙和C水以及I,据我们所学知识能够和碱反应生成三种物质的物质就是铵盐,而生成的物质中有氯化钙,我们把这个复分解反应给予还原就可以得出M为氯化铵.代入题目检验,符合题意.
故答案为:
(1)Ca(OH)2,H2O,NH4Cl.(2)刷油漆、涂油等.
(3)①Fe+2HCl=FeCl2+H2↑,④CaCl2+Na2CO3=2NaOH+CaCO3↓.
点评 本题是推断题,考查学生综合运用知识的能力,做这类题关键是找准突破口,利用物质的化学特性,顺藤摸瓜逐一推出.

练习册系列答案
相关题目
8.下列各种物质中,都是由离子构成的一组是( )
| A. | 铁和铜 | B. | 氯化钠和硫酸铜 | C. | 水和二氧化碳 | D. | 氧气和氢气 |
13.已知:Al(OH)3可与NaOH溶液反应生成能溶于水的NaAlO2,即Al(OH)3+NaOH=NaAlO2+2H2O.在100g质量分数为9.8%的稀硫酸中加入ag镁铝合金粉末,合金完全溶解,然后向所得混合溶液中加入质量分数为8%的氢氧化钠溶液,若要使沉淀质量最大,加入的氢氧化钠溶液的质量为( )
| A. | 200g | B. | 100g | C. | 50g | D. | 25g |
3.下列情况不会污染空气的是( )
| A. | 人和动物的呼吸 | B. | 焚烧塑料垃圾 | C. | 工厂的废气 | D. | 汽车排放的尾气 |
14.下列物质久置敞口容器中,质量会增加但不会变质的是( )
| A. | 食盐 | B. | 氢氧化钠 | C. | 浓硫酸 | D. | 浓盐酸 |
