题目内容
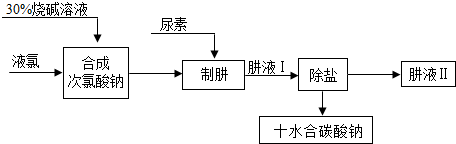
6.地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.通过海水晒制可得粗盐,已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
(1)用托盘天平称量粗盐时,若指针偏向右边,则表示(填下列正确选项的代码)D.
A.右盘重,砝码轻 B.右盘轻,样品重 C.左盘重,样品轻 D.左盘轻,砝码重
(2)第④步操作发生反应的化学方程式是2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
(3)第⑤步操作的目的是除去氯化钙和过量的氯化钡.
(4)第⑥步操作a的名称是过滤该操作中,有可能影响操作效果的原因可能有:液面高于滤纸边缘(一条即可).
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去碳酸钠和氢氧化钠.
(6)在第⑧步操作时,根据的原理是氯化钠的溶解度受温度影响变化不大.
分析 根据托盘天平的使用、氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠、碳酸钠能与氯化钙和氯化钡反应、盐酸能与氢氧化钠和碳酸钠反应以及过滤操作的注意事项、结晶方法选择的原理进行分析解答即可.
解答 解:(1)用托盘天平称量粗盐时,若指针偏向右边,说明左盘轻,砝码重,故填:D;
(2)第④步操作是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,发生反应的化学方程式是2NaOH+MgCl2═Mg(OH)2↓+2NaCl,故填:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
(3)第⑤步操作加入过量的碳酸钠溶液,能除去氯化钙和过量的氯化钡,故其目的是除去氯化钙和过量的氯化钡,故填:除去氯化钙和过量的氯化钡.
(4)第⑥步操作得到的不溶性固体和溶液,故a的名称是过滤,该操作中,有可能影响操作效果的原因可能是液面高于滤纸边缘,故填:过滤,液面高于滤纸边缘;
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去过量的碳酸钠和氢氧化钠,故填:除去碳酸钠和氢氧化钠.
(6)在第⑧步操作是蒸发,由于氯化钠的溶解度受温度影响变化不大,故选用蒸发结晶的方法,故根据的原理是氯化钠的溶解度受温度影响变化不大,故填:氯化钠的溶解度受温度影响变化不大.
点评 本题以海水中粗盐提纯为知识背景,考查了常见仪器的使用、化学方程式的书写、物质的性质以及溶解度的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于煤、石油、天然气说法不正确的是( )
| A. | 它们都属于混合物 | |
| B. | 目前我市公交车、出租车都有CNG标志,这类车都是以天然气为燃料,可减轻对空气污染 | |
| C. | 它们蕴藏量有限,是人们可利用的唯一能源,非常宝贵 | |
| D. | 直接燃烧石化燃料既污染环境,又浪费资源 |
14.某物质在隔绝空气加强热时生成的二氧化碳和水,则此物质的组成叙述正确的是( )
| A. | 一定含碳、氢、氧三种元素 | B. | 一定只含氧元素 | ||
| C. | 一定含碳元素和氢元素 | D. | 一定不含氧元素 |
1.下列有关说法有错误的是( )
| A. | 碳能形成多种单质,如:金刚石、石墨、C60等.碳具有还原性,用焦炭可冶炼铁 | |
| B. | SO3、CO2、CO是非金属氧化物,都可用NaOH溶液吸收 | |
| C. | C、CO、CH4、C2H2OH均能作为燃料使用 | |
| D. | 铁是化学性质比较活泼的金属,除与氧气反应外,还能与某些酸和盐溶液发生置换反应 |
11.如图所示的实验操作正确的是( )
| A. |  实验室制取二氧化碳 | B. |  盖灭酒精灯 | ||
| C. |  实验室制取氧气 | D. |  过滤 |
15.漂白液是家庭常用的洗涤剂.化学兴趣小组的小明同学在家发现半瓶敞口放置的漂白液,对漂白液的漂白原理和该漂白液是否失效产生了疑问.他将该漂白液带到学校,在老师的指导下,与小组同学一起进行了探究.
【查阅资料】
①漂白液的制取原理:Cl2+2NaOH═NaClO+NaCl+H2O,其有效成分是NaClO.
②漂白液的漂白原理:NaClO在空气中发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO.
生成的HClO能使有色布条(含有机色素)褪色.
③HClO不稳定,易分解,分解后丧失漂白作用.
④碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应,写出该反应的化学方程式Na2CO3+CaCl═CaCO3↓+2NaCl.
【提出问题1】该漂白液是否失效?
【实验探究1】请将下述实验报告填写完整.
【提出问题2】该漂白液的主要成分是什么?
【提出猜想】该漂白液的主要成分可能是:
①NaCl ②NaCl、Na2CO3 ③NaCl、Na2CO3、NaOH
【实验探究2】
【实验反思】漂白液开瓶后要尽快使用,每次使用后要拧紧瓶盖.
【查阅资料】
①漂白液的制取原理:Cl2+2NaOH═NaClO+NaCl+H2O,其有效成分是NaClO.
②漂白液的漂白原理:NaClO在空气中发生反应:2NaClO+H2O+CO2═Na2CO3+2HClO.
生成的HClO能使有色布条(含有机色素)褪色.
③HClO不稳定,易分解,分解后丧失漂白作用.
④碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应,写出该反应的化学方程式Na2CO3+CaCl═CaCO3↓+2NaCl.
【提出问题1】该漂白液是否失效?
【实验探究1】请将下述实验报告填写完整.
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量的该漂白液加入到烧杯中,再放入有色布条 | 一段时间后,有色布条没有变化 | 该漂白液已完全失效 |
【提出猜想】该漂白液的主要成分可能是:
①NaCl ②NaCl、Na2CO3 ③NaCl、Na2CO3、NaOH
【实验探究2】
| 实验操作及实验现象 | 实验结论 |
| 取少量该漂白液于试管中,加入过量的稀盐酸.观察到有气泡产生 | 猜想①不合理 |
| 取一定量的漂白液于试管中,加入过量的CaCl2溶液使Na2CO3完全反应,静置后向上层清液中滴加酚酞溶液,无明显变化 | 猜想③不合理,②合理 |
8.叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
【查阅资料】
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】
(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
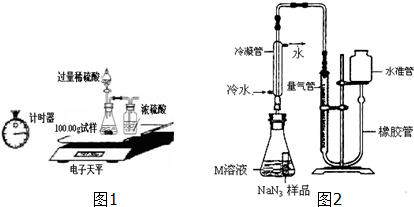
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如下:
①写出锥形瓶中发生的反应方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】
(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).

【查阅资料】
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】
(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如下:
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】
(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).