题目内容
12. 北京市加碘低钠盐的标签
北京市加碘低钠盐的标签配料表:
氯化钠含量:(60~80)g/100g
氯化钾含量:(20~35)g/100g
碘元素含量【含在碘酸钾(KIO3)中】:(18~33)mg/kg
抗 结 剂:亚铁氰化钾
储存方法:置于干燥阴凉处储存
食用方法:待食品熟后加入
请回答下列问题:
(1)碘酸钾(KIO3)中碘元素的化合价为+5;
(2)右图里“含碘量”中的碘是指B;
A.碘酸钾 B.碘元素 C.碘单质 D.碘分子
(3)根据包装袋上所要求的食用和储存方法,可以推测碘酸钾可能的化学性质为受热易分解;
(4)碘酸钾中钾、碘、氧三种元素的质量比为39:127:48;
(5)碘酸钾中碘元素的质量分数为59.3%;(计算结果保留一位小数,下同)
(6)根据资料卡片,北京市实行新标准后,每千克食用盐中少加了8.4mg的碘酸钾.
(7)若该低钠盐中碘元素含量为25mg/kg,中国营养学会推荐成年人每天摄入碘的量为 15mg,若其中90%来源于食盐,则每天食用该碘盐的质量为5.4g即.
分析 (1)根据在化合物中正负化合价代数和为零,进行解答;
(2)“含碘量”中的碘是指碘元素;
(3)根据包装袋上所要求的食用和储存方法,可以推测碘酸钾可能的化学性质;
(4)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(5)根据化合物中元素的质量分数公式进行分析解答;
(6)根据题意,由原来每千克食盐含碘30mg下调至25mg,化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答;
(7)根据题意分析解答.
解答 解:
(1)根据在化合物中正负化合价代数和为零,K元素的化合价为+1,氧元素的化合价为-2,可得碘酸钾中碘元素的化合价为:(+1)+x+(-2)×3=0,解答 x=+5;
(2)“含碘量”中的碘是指碘元素;
(3)根据包装袋上所要求的食用和储存方法,可以推测碘酸钾可能的化学性质受热易分解;
(4)碘酸钾中钾元素、碘元素、氧元素的质量比为127:39:(16×3)=39:127:48.
(5)碘酸钾中碘元素的质量分数为碘元素的质量分数$\frac{127}{214}$×100%≈59.3%.
(6)根据题意,由原来每千克食盐含碘30mg下调至25mg,加碘食盐每袋应比调整前碘元素的质量减少了(30mg-25mg)÷2=2.5mg,则每千克食用盐中少加了2.5mg×2÷59.3%≈8.4mg.
(7)成年人每天摄入碘的量为0.15mg,若其中90%来源于食盐,食盐提供的碘为0.15mg×90%=0.135mg,则每天食用该碘盐的质量为0.135mg×1000g÷25mg
=5.4g.
答案:(1)+5;(2)B;(3)受热易分解;(4)39:127:48;(5)59.3%;(6)8.4;(7)5.4.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
| A. | 将大量的氧气压缩在很小的蓝色钢瓶中-------分子间有间隔 | |
| B. | 厨房中报警器检测到煤气泄漏-------分子在不断运动 | |
| C. | .踩扁的乒乓球放热水中恢复原状-------分子的体积变大 | |
| D. | 水在通电条件下生成氢气和氧气-------氢、氧原子重新组合 |
| 选项 | 物质 | 所含杂质 | 除去方法 | 反应类型 |
| A | CuO粉 | Cu粉 | 在空气中加热 | 化合反应 |
| B | Cu | Ag | 放入硝酸银溶液,并过滤 | 置换反应 |
| C | H2 | HCl | 通过盛氢氧化钠溶液的洗气瓶 | 分解反应 |
| D | KCl | K2CO3 | 溶解,加足量的氯化钡溶液,并过滤 | 复分解反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 缺钙会引起贫血 | B. | 缺锌易产生龋齿 | ||
| C. | 缺铁会引起食欲不振,生长迟缓 | D. | 缺碘会引起甲状腺肿大 |

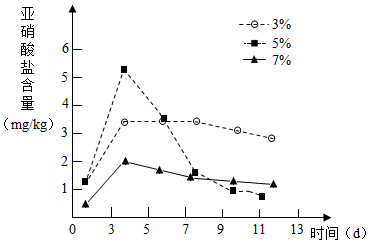 针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答:
针对泡菜在发酵过程中会产生亚硝酸盐(致癌物质)的事实,某活动小组设计实验,探究不同食盐浓度和发酵时间对亚硝酸盐含量变化的影响,请回答: