题目内容
12.治理被Cd2+ (镉,相对原子质量112)污染河水的方法是:使Cd2+沉淀以降低河水中Cd2+的浓度.查得25℃,Cd(0H)2(相对分子质量146)、CdCO3(相对分子质量172)的溶解度分别为1.7×10-4 g、2.8×10-6 g.问分别把适量的NaOH、Na2CO3投入被Cd污染的河水中形成Cd(0H)2、CdCO3沉淀后,河水中Cd2+ 的浓度能否达到国家要求的标准:≤0.005mg/L(河水密度为0.1g/cm3)分析 对于该题我们可以通过其溶解度的有关知识完成,因为形成镉的沉淀后还有极少量的镉离子存在于水中,所以该问题就转化为利用溶解的沉淀求出镉的质量,据此分析解答即可.
解答 解:设取1L这样的河水(1kg),加适量的氢氧化钠使其中的镉全部变成Cd(OH)2,此时少量的该沉淀溶解,成为此时该沉淀的饱和溶液,则依据此时该物质的溶解度可知1kg河水可溶解的Cd(OH)2质量为1.7×10-4×$\frac{1000g}{100g}$=1.7×10-3 g,其中溶解的Cd2+离子的质量为1.7×10-3g×$\frac{112}{146}$=1.3 mg;
溶解极少量的溶质基本不改变溶液体积,故这1L河水中Cd2+的浓度为1.3mg/L.
类似的做法可知类似,饱和CdCO3的溶液中Cd2+浓度为2.8×10-6×10×$\frac{112}{172}$g/L=0.018mg/L,加碳酸钠仍不能达标.
故答案为:Cd(OH)2:1.3 mg/L>0.005 mg/L不符合;CdCO3:0.018 mg/L>0.005 mg/L不符合.
点评 此题是一道溶解度计算的变形题,解题的关键是能够利用溶解度的数值对溶解的离子质量的计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列实验方案不合理的是( )
| A. | 用氢氧化钡溶液区分硫酸铵、硫酸镁和硝酸铜 | |
| B. | 用碳酸钠和氢氧化钙制备氢氧化钠 | |
| C. | 用氢氧化钠溶液和浓硫酸除去二氧化碳中的氯化氢和水蒸气 | |
| D. | 用氢氧化钙溶液除去氢氧化钠溶液中的碳酸钠 |
3.“墙角数枝梅,凌寒独自开,遥知不是雪,为有暗香来”(王安石《梅花》).诗人在远处就能闻到梅花香味的原因是( )
| A. | 分子很小 | B. | 分子是可分的 | ||
| C. | 分子之间有间隔 | D. | 分子总在不断地运动 |
7. 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
记录实验数据如表:
根据以上实验数据通过计算求:
(1)稀硫酸中溶质的质量分数.
(2)镁带样品中镁的质量分数.
(3)在坐标纸上绘出产生的气体质量与所加硫酸质量的关系曲线.
 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.记录实验数据如表:
| 加入稀硫酸次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯和所称物质总质量(克) | 120.15 | 159.95 | 199.75 | 239.55 | 279.45 | 319.45 |
(1)稀硫酸中溶质的质量分数.
(2)镁带样品中镁的质量分数.
(3)在坐标纸上绘出产生的气体质量与所加硫酸质量的关系曲线.
17.下列物质间的转化不能一步完成的是( )
| A. | CaCO3→CaO | B. | CO2→CO | C. | Fe2O3→Fe | D. | NaCl→Na2CO3 |
7.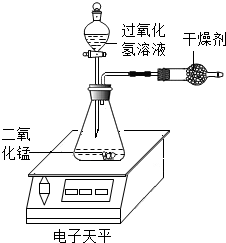 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
请你分析回答:
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
①上表数据分析得出,过氧化氢溶液分解速度的变化情况是逐渐变慢(选填“先快后慢”“先慢后快”“逐渐变慢”),原因是过氧化氢的浓度逐渐减小.
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.
 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.

 A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题:
A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题: