题目内容
20.硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.如图是由废铜料(含铁)生产硫酸铜晶体的流程.
(1)试剂X的名称是硫酸.
(2)途径Ⅰ中,反应②②的化学方程式分别为②2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;③CuO+H2SO4=CuSO4+H2O.途径Ⅱ中,反应④的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.从环保和经济的角度分析,利用途径I(选“I”、“Ⅱ”)制取硫酸铜的方案更合理.
(3)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应.现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4═ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是H2(用化学式表示),理由是:浓硫酸和锌反应生成的水使浓硫酸变成稀硫酸.
分析 (1)根据金属活动性顺序进行分析;
(2)根据铜和氧气在加热的条件下生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高进行分析;
(3)根据锌和稀硫酸反应生成硫酸锌和氢气进行分析.
解答 解:(1)废铜料中加入X得到的固体A和氧气加热胡思陈黑色固体,所以A是铜,X是酸,可以是稀硫酸;
(2)铜和氧气在加热的条件下生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4=CuSO4+H2O,途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高,所以从环保和经济的角度分析,利用途径I制取硫酸铜的方案更合理;
(3)随着浓硫酸和锌的反应,浓硫酸的质量逐渐减少,铜是反应也生成了水,浓硫酸会变成稀硫酸,锌和稀硫酸反应生成硫酸锌和氢气,所以此气体可能是H2.
故答案为:(1)稀硫酸;
(2)2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4=CuSO4+H2O,I;
(3)H2,浓硫酸和锌反应生成的水使浓硫酸变成稀硫酸.
点评 根据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
11.下列同时补充两种植物所需元素的化肥是( )
| A. | NH4Cl | B. | KCl | C. | CaHPO4 | D. | KNO3 |
8.下列措施和理由之间,无因果关系的是( )
| A. | 白磷应保存在冷水中隔绝空气--防止自燃 | |
| B. | 汽油加油站要严禁烟火--防止爆炸 | |
| C. | 家用煤气泄露时要洒大量水溶解--防止火灾 | |
| D. | 长期保存的食品真空包装隔绝空气--防止缓慢氧化 |
12.做完“铁在氧气里燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与.
【问题1】铁燃烧时溅落下来的黑色物质中还有没有铁呢?
【查阅资料1】(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);(2)铁的氧化物均能溶于酸的溶液.
【实验探究】将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料2】
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水(或在集气瓶底部铺一层细沙);
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色就说明包装盒破损进气,这样售货员就能及时发现并处理.
【问题1】铁燃烧时溅落下来的黑色物质中还有没有铁呢?
【查阅资料1】(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);(2)铁的氧化物均能溶于酸的溶液.
【实验探究】将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料2】
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
| 单位/℃ | Fe3O4 | Fe2O3 | 铁 |
| 分解温度 | 1538 | 1400 | - |
| 熔点 | - | - | 1535 |
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水(或在集气瓶底部铺一层细沙);
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色就说明包装盒破损进气,这样售货员就能及时发现并处理.
9.小明在观察KNO3 和NaCl 的溶解度曲线(如图)后,得出了如下信息,其中存在错误的是( )


| A. | 温度高于t2℃时,KNO3的溶解度大于NaCl 的溶解度 | |
| B. | t1℃时,100g水最多能溶解20g KNO3 | |
| C. | t2℃时,KNO3的溶液和NaCl的溶液中溶质的质量分数相等 | |
| D. | NaCl 的溶解度受温度的影响小,KNO3的溶解度受温度的影响大 |
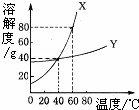 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题: