题目内容
17.证据是科学探究中获得结论的重要的依据.让我们一起经历一次寻找证据的旅程吧.【实验目的】制取纯净的硫酸钡(反应原理:Na2SO4+BaCl2═BaSO4↓+2NaCl)
【实验步骤】取一定量的硫酸钠和氯化钡溶液反应,过滤、洗涤、干燥得到纯净的硫酸钡.
(1)实验中,能直接观察到说明硫酸钠和氯化钡溶液发生化学反应的证据是:有白色沉淀生成.
(2)判断任一反应物是否完全反应的证据可按如下方法获取:
| 猜想 | 方案 | 证据 | 结论 |
| 氯化钡可能已 完全反应 | 取少量滤液,加入稀硫酸 溶液,观察现象 | 无白色沉淀生成 | 氯化钡已完全反应 |
| 硫酸钠可能已 完全反应 | 无白色沉淀生成 | 硫酸钠未完全反应 |
验制得的硫酸钡中没有氯化钠(填具体物质)来设计实验方案.
分析 根据氯化钡和硫酸钠反应生成生成硫酸钡沉淀和氯化钠,验证氯化钡可以用硫酸,验证硫酸钠可以用氯化钡等知识进行分析.
解答 解:氯化钡和硫酸钠反应生成生成硫酸钡沉淀和氯化钠,验证氯化钡可以用硫酸,验证硫酸钠可以用氯化钡,所以
(1)实验中,能直接观察到说明硫酸钠和氯化钡溶液发生化学反应的证据是:有白色沉淀生成;
(2)判断任一反应物是否完全反应的证据可按如下方法获取:
| 猜想 | 方案 | 证据 | 结论 |
| 氯化钡可能已 完全反应 | 取少量滤液,加入稀硫酸溶液,观察现象 | 无白色沉淀生成 | 氯化钡已完全反应 |
| 硫酸钠可能已 完全反应 | 取少量滤液,加入氯化钡溶液,观察现象. | 无白色沉淀生成. | 硫酸钠未完全反应 |
故答案为:(1)有白色沉淀生成;
(2)
| 猜想 | 方案 | 证据 | 结论 |
| 氯化钡可能已 完全反应 | |||
| 硫酸钠可能已 完全反应 | 取少量滤液,加入氯化钡溶液,观察现象. | 无白色沉淀生成. |
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
5.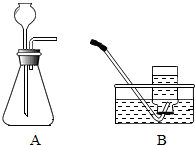 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是硫酸溶液中本身含有硫酸根离子.
【实验证明】用A、B两组仪器进行实验:
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20ml,第一份加入质量分数为10%的稀硫酸铜溶液1ml,第二份加入质量分数为10%的硫酸锌溶液1ml,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是保证气体不从漏斗处逸出,.
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125ml)所需的时间(如表),什么时间开始收集气体?等到反应开始产生气体时立刻收集.
锌与硫酸反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑.
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是锌会与硫酸铜反应生成铜.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是硫酸溶液中本身含有硫酸根离子.
【实验证明】用A、B两组仪器进行实验:
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20ml,第一份加入质量分数为10%的稀硫酸铜溶液1ml,第二份加入质量分数为10%的硫酸锌溶液1ml,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是保证气体不从漏斗处逸出,.
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125ml)所需的时间(如表),什么时间开始收集气体?等到反应开始产生气体时立刻收集.
| 编号 | 20%的硫酸各20ml | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1ml | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1ml | 1g | 3分01秒 |
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是锌会与硫酸铜反应生成铜.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸 | ②中反应速率比①快 | 产生氢气的速率较快与铜单质有关 |
| ② | 取1g锌粒于锥形瓶,加入少量铜,再加入20mL20%的稀硫酸 |
12.2010年上海世博会中国馆雄伟壮观,其主体建筑表面安装了近2万块钛(Ti)金属板,已知Ti原子核内有22个质子,则下列叙述正确的是( )
| A. | Ti可以表示一个钛原子 | B. | Ti4+核外有26个电子 | ||
| C. | TiO2中含有氧分子 | D. | CaTiO3属于金属氧化物 |
9. 如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
 如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )
如图是a、b两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )| A. | t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数 | |
| B. | t1℃时,a、b两种物质的饱和溶液溶质质量分数相同 | |
| C. | 将t2℃时b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液 | |
| D. | 若a中混有少量的b,可以用降温结晶的方法提纯a |
 如图表示某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液与20g某稀盐酸发生反应后溶液温度的变化情况,查阅资料可知,氢氧化钠和盐酸反应会放出热量.
如图表示某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液与20g某稀盐酸发生反应后溶液温度的变化情况,查阅资料可知,氢氧化钠和盐酸反应会放出热量.