题目内容
12. 图为测定空气中氧气含量装置.
图为测定空气中氧气含量装置.(1)写出该反应的化学方程式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)若测得氧气的含量少于空气体积的$\frac{1}{5}$,可能原因有哪些装置漏气;红磷的量不足(两种即可).
(3)集气瓶中剩余的约$\frac{4}{5}$的气体主要是氮气,据此推测氮气的性质不易溶于水、不燃烧也不支持燃烧(写一条).
分析 本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论.因此在选择可燃物时,必须考虑到:燃烧的条件;生成物的状态;不与空气中其他物质发生反应.保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数.
解答 解:(1)红磷燃烧生成五氧化二磷,故化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)由分析可知,造成测得的氧气体积分数小于l/5结果的可能原因:(1)红磷的量不足;(2)瓶内氧气没有耗尽;(3)装置漏气(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙等),使外界空气进入瓶内;(4)未冷却至室温就打开弹簧夹,使进入瓶内的水的体积减少.
(3)最后剩余的气体主要为氮气,根据红磷最后熄灭,瓶内进入水分析可知:氮气不易溶于水、不燃烧也不支持燃烧;
故答案为:
(1)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)装置漏气;红磷的量不足.
(3)不易溶于水、不燃烧也不支持燃烧.
点评 本考点考查了空气中氧气的含量的探究,并且注重了实验方案的评价,对实验方案进行评价是近几年中考的一个重点.评价包括对实验方案的评价、实验过程的评价、实验结论的评价等,要认真把握.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
2.利用化学方程式计算的依据是( )
| A. | 化学方程式中,各反应物质量比等于各生成物质量比 | |
| B. | 化学方程式表示了反应物和生成物的质量关系 | |
| C. | 化学方程式表示了反应物、生成物和反应条件 | |
| D. | 化学方程式表示了一种化学反应过程 |
3.影响化学反应的因素有很多,下列对各因素的说法中错误的是( )
| A. | 温度:一般情况下,温度越高,反应速率越快 | |
| B. | 反应物的浓度:一般情况下,浓度越高,反应速率越快 | |
| C. | 催化剂:加入催化剂后,反应速率都会加快 | |
| D. | 反应物之间的接触面积:接触面积越大,反应速率越快 |
20.下列实验操作或做法正确的是( )
| A. | 点燃氢气前,先检验其纯度 | |
| B. | 为了节约药品,将用剩余的药品放回原试剂瓶 | |
| C. | 实验结束后,用嘴吹灭酒精灯 | |
| D. | 将食盐放在托盘天平的右盘上称量 |
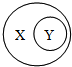 学习化学时可用右图表示某些从属关系,下列选项正确的是( )
学习化学时可用右图表示某些从属关系,下列选项正确的是( )