题目内容
2. 过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等.过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.
过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等.过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产
生氧气的曲线图.
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与
CaO2类似)样品的一些数据:
| 物质 | 相对分子质量 | 纯度 | 价格(元/kg) |
| Na2O2 | 78 | 98% | 25 |
| CaO2 | 72 | 94% | 24 |
分析 (1)根据过氧化钙与水反应方程式和氧气的质量计算过氧化钙和水的质量,再计算出该过氧化钙样品的纯度;
(2)根据过氧化钙的质量和质量关系画出出产生氧气的曲线图.
(3)根据过氧化钙的价格求出过氧化钙的质量,据此计算出生成的氧气,比较即可.
解答 解:(1)设过氧化钙的质量为X,水的质量为Y,
2CaO2+2H2O=2Ca(OH)2+O2↑
144 36 32
X Y 32g
$\frac{144}{X}=\frac{36}{Y}=\frac{32}{32g}$
解得:X=144g Y=36g
该过氧化钙样品的纯度=$\frac{144g}{150g}×100%$=96%
(2)由上述计算可知,水的质量是36g,生成的氧气是32g,所以产生氧气的曲线图如下:
(3)3000元购买过氧化钠质量=$\frac{3000元}{25元/Kg}×98%$=117.6kg
设过氧化钠产生的氧气质量为z
2Na2O2+2H2O=4NaOH+O2↑
156 32
117.6kg z
$\frac{156}{32}=\frac{117.6Kg}{z}$ 解得:z=24.1kg<26.1kg
所以过氧化钙可制得更多的氧气.
故答为:(1)过氧化钙样品的纯度是96%;
(2)产生氧气的曲线图见上图;
(3)购买过氧化钙可制得更多的O2.
点评 本题主要考查了根据化学方程式的计算,涉及的知识点较多,计算量较大,注意计算的数据要准确.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13. 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 两种物质的溶解度都随着温度的升高而增大 | |
| C. | t1℃时,60g甲加入到100g水中,充分溶解,得到160g溶液 | |
| D. | 甲、乙的饱和溶液从t2℃降温到t1℃,析出晶体的质量:甲一定小于乙 |
10.下表除去物质中所含少量杂质的方法错误的是( )
| 物质 | 杂质 | 除去杂质的方法 | |
| A | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| B | N2 | O2 | 通过灼热的铜网 |
| C | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D | CO | CO2 | 先通过足量的氢氧化钠溶液,再通过浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
7.规范的实验操作是实验成功的保证,下列实验操作正确的是( )
| A. |  配制氯化钠溶液 | B. |  闻气体气味 | C. |  检查装置气密性 | D. |  称量固体质量 |
14.下列关系中,正确的是( )
| A. | pH:酸雨>正常雨水 | |
| B. | 常温条件下在水中的溶解性:氢氧化钙>氢氧化钠 | |
| C. | 溶于水后溶液的温度:氢氧化钠>硝酸铵 | |
| D. | 所有原子中:质子数>核外电子数 |
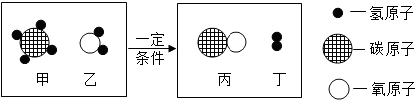
 如图是某反应的微观过程.
如图是某反应的微观过程.