题目内容
6.在暴风雪较多的地区,融雪剂发挥了重要作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK).请回答:(1)醋酸钾属于有机物(选填“无机物”或“有机物”).
(2)醋酸钾中C、H、O元素的质量比为24:3:32.
(3)醋酸钾中钾元素的质量分数为39.8%(保留一位小数).
分析 (1)根据含有碳元素的化合物叫有机化合物,简称有机物进行解答;
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(3)元素的质量分数等于某元素的质量分数=$\frac{元素的相对原子质量×原子个数}{相对分子质量}$×100%;
解答 解:(1)根据醋酸钾的化学式CH3COOK可知,醋酸钾中含有碳元素,故属于有机物;
(2)醋酸钾中C、H、O元素的质量比为(12×2):(1×3):(16×2)=24:3:32.
(3)醋酸钾中钾元素的质量分数=$\frac{钾元素的相对原子质量×原子个数}{醋酸钾的相对分子质量}$100%=$\frac{39×1}{98}$×100%=39.8%.
故答案为:(1)有机物;(2)24:3:32;(3)39.8%;
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
16.我们每天都生活在不断变化的物质世界里,下列变化一定属于化学变化的是( )
| A. | 久置在空气中的澄清石灰水表面产生一层白膜 | |
| B. | 用干冰做制冷剂进行人工降雨 | |
| C. | 伴随有发光、放热现象的变化 | |
| D. | 夏天车胎爆胎 |
1.下列过程中,没有发生化学变化的是( )
| A. | 木炭燃烧 | B. | 剩饭变馊 | C. | 冰棒融化 | D. | 火药爆炸 |
11.为得到纯净的物质,某同学设计下表中的除杂方法,其中方法正确的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CaCl2 | HCl | 加入过量CaCO3,过滤 |
| B | H2SO4 | HNO3 | 加入适量BaCl2溶液,过滤 |
| C | O2 | N2气体 | 将气体缓缓通过灼热的铜网 |
| D | Na2SO4溶液 | CuSO4 | 加入过量氢氧化钠溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
16.“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
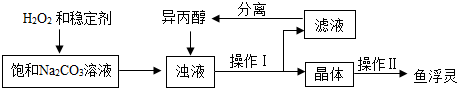
注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
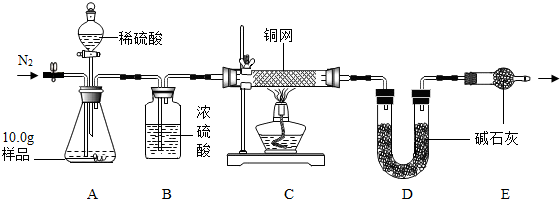
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】

注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
 环境问题是2012年“两会上”的热门话题之一.
环境问题是2012年“两会上”的热门话题之一.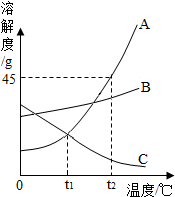 如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:
如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题: