题目内容
粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如图所示:
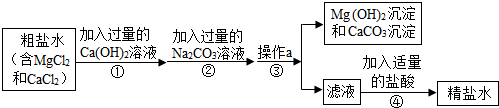
(1)Ca(OH)2溶液的pH (填“>”、“=”或“<”)7.步骤①反应的化学方程式为 .
(2)步骤③操作a的名称是 .步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和 .
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有 .
(4)若将步骤①的过量的Ca(OH)2溶液换成过量的NaOH溶液,滤液中的溶质是 .

(1)Ca(OH)2溶液的pH
(2)步骤③操作a的名称是
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有
(4)若将步骤①的过量的Ca(OH)2溶液换成过量的NaOH溶液,滤液中的溶质是
考点:氯化钠与粗盐提纯,过滤的原理、方法及其应用,溶液的酸碱性与pH值的关系,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:(1)根据氢氧化钙是常见的碱其溶液的>7和氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和氯化钙进行解答;
(2)根据过滤可用于分离可溶性固体和难溶性固体进行解答;
(3)根据氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和可溶性的氯化钙进行解答;
(4)根据氢氧化钠和氯化镁生成氯化钠和相应的沉淀氢氧化镁解答.
(2)根据过滤可用于分离可溶性固体和难溶性固体进行解答;
(3)根据氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和可溶性的氯化钙进行解答;
(4)根据氢氧化钠和氯化镁生成氯化钠和相应的沉淀氢氧化镁解答.
解答:解:(1)氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和氯化钙,化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;故填:>;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(2)过滤可用于分离可溶性固体和难溶性固体,所以步骤③中操作a的名称是过滤;碳酸钠溶液和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,所以滤液中除氯化钠、碳酸钠外还有氢氧化钠,所以步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和NaOH;故填:过滤;NaOH;
(3)氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和可溶性的氯化钙,所以若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有CaCl2.故填:CaCl2;
(4)氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠;还有过滤的氢氧化钠和原来的氢氧化钙;故答案:NaCl、氢氧化钠、氯化钙.
(2)过滤可用于分离可溶性固体和难溶性固体,所以步骤③中操作a的名称是过滤;碳酸钠溶液和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,所以滤液中除氯化钠、碳酸钠外还有氢氧化钠,所以步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和NaOH;故填:过滤;NaOH;
(3)氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和可溶性的氯化钙,所以若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有CaCl2.故填:CaCl2;
(4)氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠;还有过滤的氢氧化钠和原来的氢氧化钙;故答案:NaCl、氢氧化钠、氯化钙.
点评:本题从多个角度对氯化钠的提纯实验进行了全面考查,灵活性强,注重酸碱盐之间反应的考查.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
在一密闭的容器内有X、Y、Z、Q四种物质,在一定条件下反应一定时间,测得反应前后各物质的质量如下表:
下列说法正确的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 20 | 20 | 20 | 20 |
| 反应后质量/g | 待测 | 30 | 16 | 14 |
| A、X一定作催化剂 |
| B、该反应一定是分解反应 |
| C、Z、Q在反应中的质量比为2:3 |
| D、完全反应后,X变为0g |


 使用浓硫酸时要十分小心,浓硫酸有强烈的
使用浓硫酸时要十分小心,浓硫酸有强烈的


