题目内容
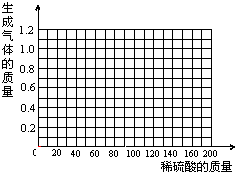
5. 有一瓶因保存不当而部分变质的氢氧化钠固体,现在需要测定其组成,以探究其变质程度.为了测定其组成成分,某研究小组称取了5.32g的NaOH样品(杂质为Na2CO3),然后配制成溶液并向溶液中逐滴加入稀盐酸,根据生成CO2的质量来测定其中Na2CO3的质量,并进一步确定样品中NaOH的变质程度.已知实验测得加入稀盐酸的质量与产生CO2气体的质量关系如下图所示.试求:
有一瓶因保存不当而部分变质的氢氧化钠固体,现在需要测定其组成,以探究其变质程度.为了测定其组成成分,某研究小组称取了5.32g的NaOH样品(杂质为Na2CO3),然后配制成溶液并向溶液中逐滴加入稀盐酸,根据生成CO2的质量来测定其中Na2CO3的质量,并进一步确定样品中NaOH的变质程度.已知实验测得加入稀盐酸的质量与产生CO2气体的质量关系如下图所示.试求:(1)反应生成的气体的质量为0.88g.
(2)样品中氢氧化钠的质量是多少?
(3)反应后刚结束时溶液中NaCl的质量分数是多少?
分析 (1)根据分析图象可知,二氧化碳的最大质量是0.88克进行解答;
(2)根据碳酸钠与盐酸反应的方程式,由二氧化碳的质量求出碳酸钠的质量、生成的氯化钠的质量,由碳酸钠的质量即可求出氢氧化钠的质量;
(3)由氢氧化钠的质量可求出与盐酸反应生成的氯化钠的质量,再根据溶质质量分数的计算公式最后求出反应后刚结束时溶液中NaCl的质量分数.
解答 解:(1)分析图象可知,二氧化碳的最大质量是0.88g;
(2)设生成0.88克二氧化碳消耗的碳酸钠的质量为x 生成的氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 0.88g
$\frac{106}{44}=\frac{x}{0.88g}$ 解得:x=2.12g y=2.34g
所以氢氧化钠的质量为:5.32g-2.12g=4.2g
(3)设4.2g氢氧化钠与盐酸反应生成的氯化钠的质量为z,
NaOH+HCl═NaCl+H2O
40 58.5
4.2g z
$\frac{40}{58.5}=\frac{4.2g}{z}$ 解得:z=6.1425g
反应后刚结束时溶液中NaCl的质量分数是:$\frac{2.34g+6.1425g}{5.32g-0.88g+100g}×100%$≈8%
答:(1)0.88g.
(2)样品中氢氧化钠的质量是4.2g.
(3)反应后刚结束时溶液中NaCl的质量分数是8%.
点评 本题主要考查了根据化学方程式的计算和有关溶质质量分数的计算.培养学生分析图形的能力,掌握化学计算的格式和规范性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20. 黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
按要求回答下列问题:
(1)根据实验数据分析,从第4份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数.(要求写出计算过程)
(3)列式计算稀硫酸的溶质质量分数.(要求写出计算过程)
(4)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线.
 黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
(1)根据实验数据分析,从第4份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数.(要求写出计算过程)
(3)列式计算稀硫酸的溶质质量分数.(要求写出计算过程)
(4)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线.
17.如图所示的基本实验操作中错误的是( )
| A. |  滴加少量液体 | B. |  塞紧橡皮塞 | C. |  读取液体体积 | D. |  闻气体气味 |
14.下列各组离子可能大量共存的是( )
| A. | 含有大量NO3-的澄清透明溶液中:K+、Cu2+、Cl-、Na+ | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 含有较多盐酸的溶液中:Na+、HCO3-、SO42-、Cl- | |
| D. | pH=7的溶液:Fe3+、Mg2+、SO42-、Cl- |
15.下列说法正确的是( )
| A. | 水是由两个氢元素和一个氧元素组成 | |
| B. | 水是由一个氢分子和一个氧原子组成 | |
| C. | 水分子是由氢元素和氧元素构成 | |
| D. | 水是由氢元素和氧元素组成 |
 某班同学用如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于原瓶内空气体积的$\frac{1}{5}$,乙同学的广口瓶内水面上升明显大于原瓶内空气体积的$\frac{1}{5}$,丙同学广口瓶内水面上升则非常接近原瓶内空气体积的$\frac{1}{5}$.下列对上述三种现象解释合理的是①②③④⑤⑥(填序号)
某班同学用如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于原瓶内空气体积的$\frac{1}{5}$,乙同学的广口瓶内水面上升明显大于原瓶内空气体积的$\frac{1}{5}$,丙同学广口瓶内水面上升则非常接近原瓶内空气体积的$\frac{1}{5}$.下列对上述三种现象解释合理的是①②③④⑤⑥(填序号)