题目内容
某化学兴趣小组进行的“对某纯碱样品(含氯化钠杂质)中碳酸钠的质量分数测定”的实验探究过程如下:
【资料准备】
Ⅰ.浓硫酸有吸水性,实验室中常用它做干燥剂;
Ⅱ.碱石灰由氢氧化钠和生石灰的混合物,常用于吸收水蒸气和二氧化碳.
【实验方案】
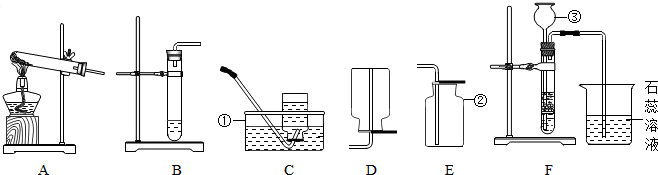
利用如图所示实验装置(铁架台略去),称取一定质量的样品和稀硫酸反应产生,通过测定生成的CO2气体的质量,测定Na2CO3的质量分数.
【交流与表达】
(1)仪器①的名称是 ,试剂X的名称是 ,装置B的作用是 ,
(2)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的 ,再接上装置C和D.
(3)关闭止水夹K,加入足量的稀硫酸(杂质不与硫酸反应),装置A中样品产生气体的化学方程式为 .
(4)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据 定律,装置 (填标号)在反应前后的质量差就是产生CO2的质量,
【反思与评价】
(5)若没有装置D,将会使测定结果 (选填“偏大”或“偏小”).
(6)实验中 (填“能”或“不能”)用稀盐酸代替稀硫酸,其原因是 .
【拓展与延伸】
(7)小组同学还设计了另一个测定纯碱样品中Na2CO3质量分数的实验方案如下表,请按要求完成下表内容.

【资料准备】
Ⅰ.浓硫酸有吸水性,实验室中常用它做干燥剂;
Ⅱ.碱石灰由氢氧化钠和生石灰的混合物,常用于吸收水蒸气和二氧化碳.
【实验方案】
利用如图所示实验装置(铁架台略去),称取一定质量的样品和稀硫酸反应产生,通过测定生成的CO2气体的质量,测定Na2CO3的质量分数.
【交流与表达】
(1)仪器①的名称是
(2)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的
(3)关闭止水夹K,加入足量的稀硫酸(杂质不与硫酸反应),装置A中样品产生气体的化学方程式为
(4)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据
【反思与评价】
(5)若没有装置D,将会使测定结果
(6)实验中
【拓展与延伸】
(7)小组同学还设计了另一个测定纯碱样品中Na2CO3质量分数的实验方案如下表,请按要求完成下表内容.
| 实验操作 | 实验现象 | 实验结论及分析 |
| 取11.8g纯碱样品配成100mL溶液,取5mL于试管中,然后滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: 滴加的CaCl2溶液要过量的原因是 |
| 将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量其质量为0.5g. | / | 样品中Na2CO3的质量分数为 (保留小数一位) |
考点:实验探究物质的组成成分以及含量,气体的净化(除杂),盐的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:科学探究
分析:【交流与表达】
(1)了解常用仪器和药品的作用;
(2)根据空气中含有二氧化碳进行解答;
(3)根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行解答;
(4)根据质量守恒定律可知,装置C中反应前后的质量差就是产生CO2的质量进行解答.
【反思与评价】
(5)考虑空气中的二氧化碳会进入装置C,影响结果进行解答.
(6)根据盐酸的性质进行回答;
(7)根据碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠进行解答;
根据滴加的CaCl2溶液要过量的原因与碳酸钠充分反应进行解答;
根据题目中的信息和化学方程式进行解答;
(1)了解常用仪器和药品的作用;
(2)根据空气中含有二氧化碳进行解答;
(3)根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行解答;
(4)根据质量守恒定律可知,装置C中反应前后的质量差就是产生CO2的质量进行解答.
【反思与评价】
(5)考虑空气中的二氧化碳会进入装置C,影响结果进行解答.
(6)根据盐酸的性质进行回答;
(7)根据碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠进行解答;
根据滴加的CaCl2溶液要过量的原因与碳酸钠充分反应进行解答;
根据题目中的信息和化学方程式进行解答;
解答:解:
【交流与表达】
(1)根据图可知:仪器①的名称是锥形瓶,试剂X的名称是稀硫酸,装置B中为浓硫酸,其作用是 吸收水份;
(2)空气中含有二氧化碳,所以打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D;故填:二氧化碳;
(3)根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(4)由质量守恒定律可知装置C中反应前后的质量差就是产生CO2的质量,装置D的作用是防止空气中的二氧化碳和水蒸气进入装置C.故填:质量守恒;C;
【反思与评价】
(5)若没有装置D,空气中的二氧化碳会进入装置C,故将会使测定结果偏大;
(6)实验中不能用稀盐酸代替稀硫酸,其原因是因为盐酸在反应过程中会产生氯化氢气体,影响实验的结果.
(7)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl;滴加的CaCl2溶液要过量的原因与碳酸钠充分反应;
设生成0.5g碳酸钙,需要碳酸钠的质量为x.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 0.5g
则
=
,解得x=0.53g,
故样品中Na2CO3的质量分数为
×100%≈89.8%
故答案为:
(1)锥形瓶;吸收水份;(2)CO2;(3)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(4)质量守恒定律; C;(5)偏大;
(6)不能,因为盐酸在反应过程中会产生氯化氢气体,影响实验的结果;
(7)Na2CO3+CaCl2═CaCO3↓+2NaCl;使样品中的碳酸钠完全反应; 89.8%
【交流与表达】
(1)根据图可知:仪器①的名称是锥形瓶,试剂X的名称是稀硫酸,装置B中为浓硫酸,其作用是 吸收水份;
(2)空气中含有二氧化碳,所以打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D;故填:二氧化碳;
(3)根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(4)由质量守恒定律可知装置C中反应前后的质量差就是产生CO2的质量,装置D的作用是防止空气中的二氧化碳和水蒸气进入装置C.故填:质量守恒;C;
【反思与评价】
(5)若没有装置D,空气中的二氧化碳会进入装置C,故将会使测定结果偏大;
(6)实验中不能用稀盐酸代替稀硫酸,其原因是因为盐酸在反应过程中会产生氯化氢气体,影响实验的结果.
(7)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl;滴加的CaCl2溶液要过量的原因与碳酸钠充分反应;
设生成0.5g碳酸钙,需要碳酸钠的质量为x.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 0.5g
则
| 106 |
| x |
| 100 |
| 0.5g |
故样品中Na2CO3的质量分数为
| 0.53g | ||
11.8g×
|
故答案为:
(1)锥形瓶;吸收水份;(2)CO2;(3)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(4)质量守恒定律; C;(5)偏大;
(6)不能,因为盐酸在反应过程中会产生氯化氢气体,影响实验的结果;
(7)Na2CO3+CaCl2═CaCO3↓+2NaCl;使样品中的碳酸钠完全反应; 89.8%
点评:本题将计算和实验有机地结合起来进行考查,通过认真审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列物质溶于水时,溶液温度明显升高的是( )
| A、氯化钠 | B、氢氧化钠 |
| C、硝酸钠 | D、硝酸铵 |
 向16克黄铜(铜-锌合金)样品中加入稀硫酸使其充分反应,经实验测得所加稀硫酸与生成气体的质量关系如图所示.
向16克黄铜(铜-锌合金)样品中加入稀硫酸使其充分反应,经实验测得所加稀硫酸与生成气体的质量关系如图所示.