题目内容
甲、乙、丙三位同学在活动课上利用如图所示装置制取常见的气体,请根据题意回答下列问题.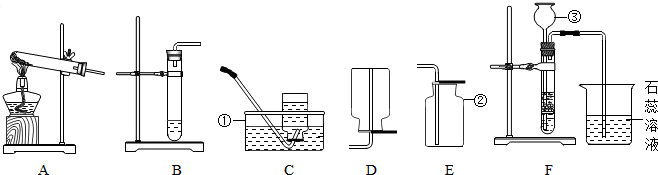
(1)写初编号仪器的名称:① ② ③
(2)甲同学用加热氯酸钾和二氧化锰的固体混合物制取O2,发生装置应选用上图中的 装置(填编号),该反应的化学方程式为 ;若用C装置收集,当O2收集满并取出集气瓶后,停止该实验的正确操作方法是 .
(3)乙同学利用B装置制取CO2,如图是乙同学在化学实验中主要操作过程的示意图.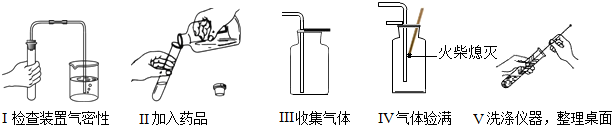
根据上述实验操作过程,.请找出乙同学的操作错误的是(填序号) 、 .
(4)丙同学用浓盐酸与大理石在F装置中制取CO2并检验其有关性质,写出制取CO2的化学方程式 ,实验中观察到烧杯内紫色石蕊试液变红,请你分析使紫色石蕊试液变红的原因可能有:
①
②
(5)实验室的废液缸内收集了同学们制取二氧化碳气体后的废液,李凡同学想探究废液中溶质的成分,请你参与下列探究活动.
【提出问题】废液中溶质是什么?
【作出假设】李凡认为废液中溶质只有CaCl2.你认为还可能含有的溶质是 .(填化学式)
【查阅资料】CaCl2溶液呈中性.
【实验与结论】①李凡取少量该废液于一支试管中,再取少量CaCl2溶液加到另一支试管中,并向两支试管中滴入无色酚酞试液做对比实验,结果溶液均为无色,于是李凡认为自己的猜想是正确的.你认为李凡的实验 (填“能”或“不能”)证明他的猜想.
②如果要证明你的猜想是正确的,取少量该废液于一支试管中,你滴入的试剂是 ,看到的现象将是试管中的液体变为红色.
【拓展与应用】如果已证明你的猜想是正确的,要想使处理后的废液中溶质只有CaCl2,可向废液中加入过量的 (填字母序号),充分反应后过滤即可.
A.石灰水 B.生石灰 C. 石灰石粉末 D.硝酸银溶液.

(1)写初编号仪器的名称:①
(2)甲同学用加热氯酸钾和二氧化锰的固体混合物制取O2,发生装置应选用上图中的
(3)乙同学利用B装置制取CO2,如图是乙同学在化学实验中主要操作过程的示意图.

根据上述实验操作过程,.请找出乙同学的操作错误的是(填序号)
(4)丙同学用浓盐酸与大理石在F装置中制取CO2并检验其有关性质,写出制取CO2的化学方程式
①
②
(5)实验室的废液缸内收集了同学们制取二氧化碳气体后的废液,李凡同学想探究废液中溶质的成分,请你参与下列探究活动.
【提出问题】废液中溶质是什么?
【作出假设】李凡认为废液中溶质只有CaCl2.你认为还可能含有的溶质是
【查阅资料】CaCl2溶液呈中性.
【实验与结论】①李凡取少量该废液于一支试管中,再取少量CaCl2溶液加到另一支试管中,并向两支试管中滴入无色酚酞试液做对比实验,结果溶液均为无色,于是李凡认为自己的猜想是正确的.你认为李凡的实验
②如果要证明你的猜想是正确的,取少量该废液于一支试管中,你滴入的试剂是
【拓展与应用】如果已证明你的猜想是正确的,要想使处理后的废液中溶质只有CaCl2,可向废液中加入过量的
A.石灰水 B.生石灰 C. 石灰石粉末 D.硝酸银溶液.
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,二氧化碳的实验室制法,制取二氧化碳的操作步骤和注意点,酸的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)根据仪器名称解答;
(2)根据反应物的状态和反应条件选择发生装置,并写出反应原理;用排水法收集时要防止水的倒流;
(3)根据各操作的注意事项分析;
(4)盐酸和大理石反应生成氯化钙、水和二氧化碳,据此书写方程式;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红;浓盐酸挥出的氯化氢气体溶于水使溶液显酸性可使石蕊变红.
(5)①实验室制取二氧化碳气体的反应物有无过量、反应产物进行分析解答;
②根据“紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色”进行分析解答;使处理后的废液中溶质只有CaCl2,可向废液中加入过量的碳酸钙粉末.
(2)根据反应物的状态和反应条件选择发生装置,并写出反应原理;用排水法收集时要防止水的倒流;
(3)根据各操作的注意事项分析;
(4)盐酸和大理石反应生成氯化钙、水和二氧化碳,据此书写方程式;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红;浓盐酸挥出的氯化氢气体溶于水使溶液显酸性可使石蕊变红.
(5)①实验室制取二氧化碳气体的反应物有无过量、反应产物进行分析解答;
②根据“紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色”进行分析解答;使处理后的废液中溶质只有CaCl2,可向废液中加入过量的碳酸钙粉末.
解答:解:(1)仪器的名称:①水槽,②集气瓶,③长颈漏斗;
(2)加热氯酸钾和二氧化锰的固体混合物制取O2,发生装置属于固体加热型,选择装置A;氯酸钾在二氧化锰的作用下生成氯化钾和氧气,方程式为:
2KClO3
2KCl+3O2↑,用排水法收集满氧气后,应该先将导管移出水面,再熄灭酒精灯,否则会引起水的倒流使试管炸裂;
(3)乙同学的操作错误有:Ⅱ倾倒液体时瓶塞没有倒放,会污染试剂;Ⅳ验满时火柴没有放在集气瓶口,伸入瓶内了;
(4)盐酸和大理石反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红,浓盐酸挥出的氯化氢气体溶于水使溶液显酸性可使石蕊变红;
(5)①实验室制取二氧化碳气体的反应物有无过量、反应产物进行分析废液中溶质中有CaCl2.还可能含有HCl;
②根据“紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色”,李凡的实验;两支试管中滴入无色酚酞试液做对比,不能证明他的猜想;滴入紫色石蕊试液试剂,看到的现象将是试管中液体变为红色.证明废液中含有HCl;
要想使处理后的废液中溶质只有CaCl2,向废液中加入过量的过量的碳酸钙粉末;故选C.
答案:(1)水槽,集气瓶,长颈漏斗;
(2)A;2KClO3
2KCl+3O2↑,先取出导气管,再熄灭酒精灯.
(3)Ⅱ、Ⅳ
(4)CaCO3+2HCl=CaCl2+CO2↑+H2O,
①生成的CO2溶于水产生H2CO3使溶液显酸性
②浓盐酸挥出的氯化氢气体溶于水使溶液显酸性.
(5)HCl;不能;紫色石蕊试液;C.
(2)加热氯酸钾和二氧化锰的固体混合物制取O2,发生装置属于固体加热型,选择装置A;氯酸钾在二氧化锰的作用下生成氯化钾和氧气,方程式为:
2KClO3
| ||
(3)乙同学的操作错误有:Ⅱ倾倒液体时瓶塞没有倒放,会污染试剂;Ⅳ验满时火柴没有放在集气瓶口,伸入瓶内了;
(4)盐酸和大理石反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红,浓盐酸挥出的氯化氢气体溶于水使溶液显酸性可使石蕊变红;
(5)①实验室制取二氧化碳气体的反应物有无过量、反应产物进行分析废液中溶质中有CaCl2.还可能含有HCl;
②根据“紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色”,李凡的实验;两支试管中滴入无色酚酞试液做对比,不能证明他的猜想;滴入紫色石蕊试液试剂,看到的现象将是试管中液体变为红色.证明废液中含有HCl;
要想使处理后的废液中溶质只有CaCl2,向废液中加入过量的过量的碳酸钙粉末;故选C.
答案:(1)水槽,集气瓶,长颈漏斗;
(2)A;2KClO3
| ||
(3)Ⅱ、Ⅳ
(4)CaCO3+2HCl=CaCl2+CO2↑+H2O,
①生成的CO2溶于水产生H2CO3使溶液显酸性
②浓盐酸挥出的氯化氢气体溶于水使溶液显酸性.
(5)HCl;不能;紫色石蕊试液;C.
点评:本题考查了氧气和二氧化碳的制取、所以操作及实验现象的分析,并明确二氧化碳和水反应生成碳酸,酸性溶液可使石蕊变红.

练习册系列答案
相关题目
荻灰在农业生产中可作为肥料,它属于( )
| A、磷肥 | B、钾肥 | C、氮肥 | D、复合肥 |

 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
