题目内容
7.下列物质在敞口的试剂瓶中放置一段时间后,发生化学变化质量增加的是( )| A. | 浓盐酸 | B. | 浓硫酸 | C. | 氯化钠固体 | D. | 氢氧化钠固体 |
分析 敞口放置在空气中一段时间后,因发生化学反应质量增加,也就是与空气中的成分发生了化学反应,生成了新的物质,据此根据常见物质的化学性质进行分析判断.
解答 解:A、浓盐酸具有挥发性,会使其质量减少,故选项错误.
B、浓硫酸具有吸水性,放置在空气中会吸收空气中的水分,使其质量增加,但发生的是物理变化,故选项错误.
C、氯化钠固体不具有吸水性、挥发性,不与空气中的物质发生化学反应,故选项错误.
D、氢氧化钠敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,故选项正确.
故选:D.
点评 本题难度不大,掌握常见的酸、碱、盐的性质、在空气中的质量变化等是正确解答此类题的关键.

练习册系列答案
相关题目
2.不锈钢材料中含有的金属铬(Cr)能提高钢的抗氧化性和耐腐蚀性,为了解金属铬与常见金属铝、铜在金属活动性顺序表中的相对位置关系,小娟与小涛分别进行了如下探究活动.
【猜想和假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Cr Al Cu; 猜想二:Al Cr Cu; 猜想三:Al Cu Cr.
【实验和探究】
(1)小娟的实验:取大小相同的铝、铬、铜三种金属片(用砂纸打磨光亮)
(2)小涛的实验:小涛只选用了三种药品进行实验,也得出了三种金属在金属活动性顺序表中的相对位置关系.则他选用的三种药品可能是Al、CrSO4溶液、Cu.
【归纳和总结】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;
②通过金属与盐溶液反应比较.
【猜想和假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Cr Al Cu; 猜想二:Al Cr Cu; 猜想三:Al Cu Cr.
【实验和探究】
(1)小娟的实验:取大小相同的铝、铬、铜三种金属片(用砂纸打磨光亮)
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中加入等质量、等浓度的稀硫酸,然后将铝、铬、铜三种金属片分别插入三支试管中 | 铝片表面产生气泡较快;铬片表面产生气泡较缓慢,溶液变蓝色;铜片无明显现象 | 猜想二成立. 铬与稀硫酸反应生成蓝色的硫酸亚铬(CrSO4),反应的化学方程式为Cr+H2SO4=CrSO4+H2↑ |
【归纳和总结】由上述实验得出比较金属活动性强弱的方法有:
①通过金属与酸反应比较;
②通过金属与盐溶液反应比较.
4.我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数比).某实验小组为测定其组成,称取该天然碱样品16.6g进行如下实验:
资料Ⅰ:碳酸氢钠不稳定,加热易分解为碳酸钠、二氧化碳和水,而碳酸钠比较稳定,
加热时不分解;
资料Ⅱ:图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
资料Ⅲ:装置C、F、G中都是碱石灰(CaO与NaOH的固体混合物)
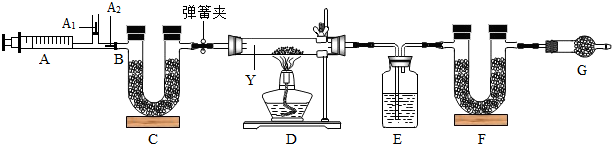
【实验步骤】①连接好装置,先检查装置的气密性;②反复推拉注射器;③称量E、F的质量;④关闭弹簧夹,加热D处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量E、F的质量.
问题探究】
(1)仪器Y的名称是硬质玻璃管;
(2)实验步骤①连接好装置,先检查装置的气密性;
(3)E中的药品为浓硫酸(填名称),目的是吸收水蒸气,F的作用是吸收生成的二氧化碳,G的作用是防止空气中的二氧化碳和水蒸气被F吸收;
(4)实验步骤②与③能否颠倒不能(填“能”或“不能”). 若无装置C,则所测得的碳酸氢钠质量分数偏大(填“偏大”、“偏小”、“无影响”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数偏小(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是使残留在装置中的二氧化碳和水蒸气充分被吸收.
(5)写出装置D中发生的化学反应化学方程式aNa2CO3•bNaHCO3•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$$\frac{2a+b}{2}$Na2CO3+$\frac{b+2c}{2}$H2O+$\frac{b}{2}$CO2↑(计量数用abc表示)
(6)通过右表数据,求得该天然碱化学式中a:b:c=2:1:2.(写出过程,4分)
资料Ⅰ:碳酸氢钠不稳定,加热易分解为碳酸钠、二氧化碳和水,而碳酸钠比较稳定,
加热时不分解;
资料Ⅱ:图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
资料Ⅲ:装置C、F、G中都是碱石灰(CaO与NaOH的固体混合物)

【实验步骤】①连接好装置,先检查装置的气密性;②反复推拉注射器;③称量E、F的质量;④关闭弹簧夹,加热D处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量E、F的质量.
问题探究】
(1)仪器Y的名称是硬质玻璃管;
(2)实验步骤①连接好装置,先检查装置的气密性;
(3)E中的药品为浓硫酸(填名称),目的是吸收水蒸气,F的作用是吸收生成的二氧化碳,G的作用是防止空气中的二氧化碳和水蒸气被F吸收;
(4)实验步骤②与③能否颠倒不能(填“能”或“不能”). 若无装置C,则所测得的碳酸氢钠质量分数偏大(填“偏大”、“偏小”、“无影响”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数偏小(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是使残留在装置中的二氧化碳和水蒸气充分被吸收.
(5)写出装置D中发生的化学反应化学方程式aNa2CO3•bNaHCO3•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$$\frac{2a+b}{2}$Na2CO3+$\frac{b+2c}{2}$H2O+$\frac{b}{2}$CO2↑(计量数用abc表示)
| 反应前 | 反应后 | |
| 装置E的质量/g | 100.0 | 102.25 |
| 装置F的质量/g | 50.0 | 51.1 |



 水时生命之源.
水时生命之源.