题目内容
17.把8g含杂质的锌片(杂质不与硫酸反应,也不溶于水)放在100g稀硫酸中,恰好完全反应.反应后得到的混合物总质量是107.8g.(反应原理:Zn+H2SO4=ZnSO4+H2↑)(1)根据质量守恒定律,反应后生成的氢气质量是0.2g.
(2)求锌片中锌的质量分数.
分析 根据质量守恒定律可知反应前后物质的质量之差即为该反应生成的氢气质量,而后利用氢气的质量依据反应的方程式即可计算出反应的锌的质量,进而可得锌的质量分数.
解答 解:(1)根据质量守恒定律可知反应前后物质的质量之差即为该反应生成的氢气质量,则氢气的质量为:8g+100g-107.8g=0.2g.
(2)设反应的锌的质量是x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
则锌的质量分数为$\frac{6.5g}{8g}$×100%=81.25%
故答案为:(1)质量守恒;0.2;(2)81.25%;
点评 本题主要考查学生运用化学方程式进行计算的能力,难度不大、题型基础.

练习册系列答案
相关题目
7.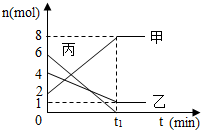 容器中含有甲、乙、丙三种物质,在一定条件下发生化学反应.甲、乙、丙的物质的量(n)随着反应时间(t)的变化如图所示.有关说法正确的是( )
容器中含有甲、乙、丙三种物质,在一定条件下发生化学反应.甲、乙、丙的物质的量(n)随着反应时间(t)的变化如图所示.有关说法正确的是( )
 容器中含有甲、乙、丙三种物质,在一定条件下发生化学反应.甲、乙、丙的物质的量(n)随着反应时间(t)的变化如图所示.有关说法正确的是( )
容器中含有甲、乙、丙三种物质,在一定条件下发生化学反应.甲、乙、丙的物质的量(n)随着反应时间(t)的变化如图所示.有关说法正确的是( )| A. | 该反应生成8mol甲 | |
| B. | 甲一定是化合物 | |
| C. | 该反应为分解反应 | |
| D. | 参加反应的乙和丙的物质的量之比为2:3 |
5.下列变化属于化学变化的是( )
| A. | 酒精挥发 | B. | 冰雪融化 | C. | 白磷自然 | D. | 瓷碗破碎 |
 在C、H、O、Na、Cl、Ca六种元素中选择合适的按要求填空:
在C、H、O、Na、Cl、Ca六种元素中选择合适的按要求填空: