题目内容
9.已知A、C均为氧化物,且A、B为黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.请回答: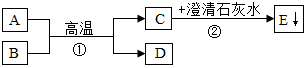
(1)A的化学式CuO.
(2)写出相关反应的化学方程式:反应①为:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;反应②为:Ca(OH)2+CO2═CaCO3↓+H2O.
分析 本题的突破口是C和澄清的石灰水反应生成沉淀E,可推的C为二氧化碳,E就为碳酸钙,又知A为黑色粉末,B为单质,D为红色单质,且A和B高温下可反应生成C和D,可推知A就是氧化铜,B就是碳,D就是铜,代入原题,进行验证,符合题意,可以据此解答.
解答 解:本题的突破口是“C和澄清的石灰水反应生成沉淀E”,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,可推的C为二氧化碳,E就为碳酸钙,又知A为黑色粉末,B为单质,D为红色单质,则D可能是铜,且A和B高温下可反应生成C和D,所以A就是氧化铜,B就是碳,带入框图,推断合理;
(1)由分析可知A是氧化铜,则其化学式为CuO;
(2)反应①是氧化铜与碳加热反应生成铜和二氧化碳,化学方程式为:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;故填:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
反应②是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,故填:Ca(OH)2+CO2═CaCO3↓+H2O.
点评 本题为框图式推断题,解题关键是从信息中找准突破口,直接得出答案,然后再顺推或逆推或向中间推的方法推测出其它答案,做出正确解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.分子、原子、离子都是构成物质的微粒,下列物质由离子构成的是( )
| A. |  氯化钠 | B. |  铜 | C. |  干冰 | D. |  金刚石 |
14.同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】A、B、C、D四组同学分别进行了图1实验:

写出下列的两个方程式:
?A中的反应2NaOH+H2SO4=Na2SO4+2H2O
?B中的反应K2CO3+H2SO4═K2SO4+H2O+CO2↑
【挖掘实质】图2是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O,完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,向无色溶液中滴加紫色石蕊试剂,变为红色.
(1)溶液中的白色沉淀一定是硫酸钡,理由是无色溶液滴加紫色石蕊试剂,变为红色,说明得到无色溶液为酸性,酸过量,亦说明白色沉淀不能溶于酸
(2)废液中一定不含有的离子是OH-和CO32-
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
【实验探究】A、B、C、D四组同学分别进行了图1实验:

写出下列的两个方程式:
?A中的反应2NaOH+H2SO4=Na2SO4+2H2O
?B中的反应K2CO3+H2SO4═K2SO4+H2O+CO2↑
【挖掘实质】图2是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O,完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,向无色溶液中滴加紫色石蕊试剂,变为红色.
(1)溶液中的白色沉淀一定是硫酸钡,理由是无色溶液滴加紫色石蕊试剂,变为红色,说明得到无色溶液为酸性,酸过量,亦说明白色沉淀不能溶于酸
(2)废液中一定不含有的离子是OH-和CO32-
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
| 溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
| ?①可能含有Ba2+ | ②取滤液滴加硫酸钠溶液 | 现象明显 | 含有该离子 |
1.某同学做了如图所示的实验并记录数据如下:

(1)实验中生成银的化学方程式有Fe+2AgNO3═Fe(NO3)2+2Ag,Cu+2AgNO3═Cu(NO3)2+2Ag;
(2)实验2后滤渣的成分为银、铜;
(3)求实验1中铁所置换出的银质量(x)的比例式为$\frac{56}{2.8g}$=$\frac{216}{x}$;
(4)用硝酸银固体配制实验中所需的硝酸银溶液,需要水的质量为149g;
(5)向实验3所得滤液中加入16g水,此时溶液中溶质的质量分数为18.4%.

| 硝酸银溶液的质量 | 铜粉的质量 | 铁粉的质量 | 所得滤渣的质量 | |
| 实验1 | 200g | 3.2g | 2.8g | 21.6g |
| 实验2 | 200g | 4.8g | 2.8g | 23.2g |
| 实验3 | 200g | 3.2g | 5.6g | 24.8g |
| 实验4 | 200g | 4.8g | 5.6g | 26.4g |
(2)实验2后滤渣的成分为银、铜;
(3)求实验1中铁所置换出的银质量(x)的比例式为$\frac{56}{2.8g}$=$\frac{216}{x}$;
(4)用硝酸银固体配制实验中所需的硝酸银溶液,需要水的质量为149g;
(5)向实验3所得滤液中加入16g水,此时溶液中溶质的质量分数为18.4%.