题目内容
将150毫升稀盐酸,密度为1.1g/cm3加入盛有53克含有少量杂质的石灰石烧杯中,恰好完全反应,杂质不反应也不溶于水,反应后烧杯中的总质量为196克.计算
(1)反应生成二氧化碳的质量
(2)石灰石中含碳酸钙的质量分数
(3)反应后溶液中溶质的质量分数.
(1)反应生成二氧化碳的质量
(2)石灰石中含碳酸钙的质量分数
(3)反应后溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因为此反应中生成的二氧化碳气体逸出,故生成二氧化碳的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
(2)根据碳酸钙与稀盐酸反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出参与反应的CaCO3的质量;然后根据质量分数公式计算即可;
(3)由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出发生反应的碳酸钙的质量和生成氯化钙的质量,结合烧杯中剩余物的质量可以计算出所得溶液中溶质的质量分数.
(2)根据碳酸钙与稀盐酸反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出参与反应的CaCO3的质量;然后根据质量分数公式计算即可;
(3)由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出发生反应的碳酸钙的质量和生成氯化钙的质量,结合烧杯中剩余物的质量可以计算出所得溶液中溶质的质量分数.
解答:解:(1)生成二氧化碳的质量为:150mL×1cm3/mL×1.1g/cm3+53g-196g=22g;
(2)设石灰石中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 22g
=
=
x=50g,y=55.5g
石灰石中碳酸钙的质量分数为
×100%≈94.3%
(3)生成物溶液中溶质的质量分数为
×100%≈28.8%
答:(1)生成二氧化碳的质量为22g.
(2)石灰石中碳酸钙的质量分数为94.3%.
(3)反应后溶液中溶质的质量分数为28.8%.
(2)设石灰石中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 22g
| 100 |
| x |
| 111 |
| y |
| 44 |
| 22g |
x=50g,y=55.5g
石灰石中碳酸钙的质量分数为
| 50g |
| 53g |
(3)生成物溶液中溶质的质量分数为
| 55.5g |
| 196g-(53g-50g) |
答:(1)生成二氧化碳的质量为22g.
(2)石灰石中碳酸钙的质量分数为94.3%.
(3)反应后溶液中溶质的质量分数为28.8%.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
关于化学方程式的意义的说法,下列不正确的是( )
| A、表明的反应的反应物、生成物 |
| B、表示各物质之间的质量比 |
| C、表明的反应的速率 |
| D、表明了反应的条件 |
下列变化中,一种变化与另外三种变化有本质的区别是( )
| A、石蜡熔化 | B、钢铁生锈 |
| C、汽油挥发 | D、石墨导电 |

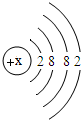 某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则该元素的质子数x为
某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则该元素的质子数x为