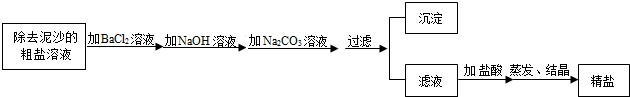
题目内容
同学们称量了5.0g粗盐,在老师的指导下经过提纯操作,得到了较纯的精盐.请回答下列问题.(1)在除去不溶性杂质实验中用得最多的仪器是______.
(2)除去泥沙等不溶性杂质后,粗盐中还含有氯化镁、氯化钙、硫酸钠等可溶性杂质.将这些可溶性杂质清除的实验方案如下(所加试剂均稍过量):

①加入Na2CO3溶液发生的化学反应用化学方程式可表示为______,______.
②过滤后得到的沉淀除有氢氧化镁、碳酸钙、硫酸钡外,还有______;所得滤液中的溶质除NaCl外,还有Na2CO3和______,在蒸发食盐水时为防止液滴飞溅,操作时应连续搅拌,还应______.
【答案】分析:(1)根据除去不溶性杂质的步骤考虑;(2)①根据加入的碳酸钠的作用考虑,不仅是除去氯化钙,还除去过量的氯化钡,再结合方程式的写法考虑;②根据碳酸钠与氯化钡反应的生成物考虑沉淀的种类;根据为了把杂质除净,加入氢氧化钠和碳酸钠都过量考虑滤液的成分,根据蒸发的注意事项回答最后一问.
解答:解:(1)除去不溶性杂质的步骤是溶解、过滤,都用到了玻璃棒;
(2)①加入的碳酸钠的作用不仅是除去氯化钙,还除去过量的氯化钡,所以发生了两个方程式,第一个反应的反应物是氯化钙和碳酸钠,生成物是碳酸钙和氯化钠,用观察法配平,碳酸钙后面标上沉淀符号;第二个反应的反应物是氯化钡和碳酸钠,生成物是碳酸钡和氯化钠,用观察法配平,碳酸钡后面标上沉淀符号;
②碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,所以沉淀还有碳酸钡沉淀;为了把杂质除净,加入的氯化钡、氢氧化钠和碳酸钠都过量,过量的氯化钡被后面的碳酸钠反应掉了,但过量的氢氧化钠和碳酸钠都进入了滤液中;蒸发时待大部分晶体结晶析出后停止加热,靠余热将剩余晶体再结晶析出.
故答案为:(1)玻璃棒;(2)①CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;②碳酸钡;NaOH;在出现较多量晶体时停止加热.
点评:解答本题关键是要知道加入氯化钡是为了除去硫酸钠,加入氢氧化钠是为了除去氯化镁,加入碳酸钠是为了除去过量的氯化钡和氯化钙.为了把杂质除净加入的试剂必须过量,最后过量的氢氧化钠和碳酸钠用盐酸反应掉.
解答:解:(1)除去不溶性杂质的步骤是溶解、过滤,都用到了玻璃棒;
(2)①加入的碳酸钠的作用不仅是除去氯化钙,还除去过量的氯化钡,所以发生了两个方程式,第一个反应的反应物是氯化钙和碳酸钠,生成物是碳酸钙和氯化钠,用观察法配平,碳酸钙后面标上沉淀符号;第二个反应的反应物是氯化钡和碳酸钠,生成物是碳酸钡和氯化钠,用观察法配平,碳酸钡后面标上沉淀符号;
②碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,所以沉淀还有碳酸钡沉淀;为了把杂质除净,加入的氯化钡、氢氧化钠和碳酸钠都过量,过量的氯化钡被后面的碳酸钠反应掉了,但过量的氢氧化钠和碳酸钠都进入了滤液中;蒸发时待大部分晶体结晶析出后停止加热,靠余热将剩余晶体再结晶析出.
故答案为:(1)玻璃棒;(2)①CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;②碳酸钡;NaOH;在出现较多量晶体时停止加热.
点评:解答本题关键是要知道加入氯化钡是为了除去硫酸钠,加入氢氧化钠是为了除去氯化镁,加入碳酸钠是为了除去过量的氯化钡和氯化钙.为了把杂质除净加入的试剂必须过量,最后过量的氢氧化钠和碳酸钠用盐酸反应掉.

练习册系列答案
相关题目
某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中.在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
则:反应中产生氢气 克,这种钢样品中铁的含量是多少?(精确到0.1%)
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中.在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
(1)反应中产生氢气 克,这种钢样品中铁的含量是多少?(精确到0.1%)
(2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是炭,则这种钢属于 .
(3)有同学提出:灼烧可使钢中的炭变为CO2挥发掉,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是 .
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
(2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是炭,则这种钢属于
(3)有同学提出:灼烧可使钢中的炭变为CO2挥发掉,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是