题目内容
某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中.在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
(2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是炭,则这种钢属于
(3)有同学提出:灼烧可使钢中的炭变为CO2挥发掉,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是
分析:(1)随钢样中铁不断与稀盐酸反应放出氢气,剩余物质的质量不断减小,待质量不再改变时完全反应;根据质量守恒定律,由完全反应时质量差,求得放出氢气质量;根据反应的化学方程式,由产生氢气质量计算钢样中所含量铁的质量,并计算中这种钢样品中铁的含量即质量分数;
(2)根据钢样中铁的含量推算出含碳量,并与分类标准进行对比,判断钢的类别;
(3)根据燃烧时碳生成二氧化碳使质量减小,同时铁与氧气生成铁的氧化物而使质量增大,对比二者变化量,解释质量反而增加了很多的原因.
(2)根据钢样中铁的含量推算出含碳量,并与分类标准进行对比,判断钢的类别;
(3)根据燃烧时碳生成二氧化碳使质量减小,同时铁与氧气生成铁的氧化物而使质量增大,对比二者变化量,解释质量反而增加了很多的原因.
解答:解:(1)根据质量守恒定律,反应中产生氢气质量=5.7g+10.0g+10.0g-25.5g=0.2g
设5.7g钢样品中含铁质量为x,则:
Fe+2HCl═FeCl2+H2↑
56 2
x 0.2g
=
x=5.6g
则这种钢样品铁的含量=
×100%=98.2%
(2)该钢样中含碳量=1-98.2%=1.8%,0.6%<1.8%<2%,∴属于高碳钢;
(3)灼烧后钢样品时,碳生成二氧化碳使质量减小,同时铁与氧气生成铁的氧化物而使质量增大;钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物增加的质量;
故答案为:
(1)0.2;98.2%;(2)高碳钢;(3)钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物增加的质量.
设5.7g钢样品中含铁质量为x,则:
Fe+2HCl═FeCl2+H2↑
56 2
x 0.2g
| 56 |
| x |
| 2 |
| 0.2g |
则这种钢样品铁的含量=
| 5.6g |
| 5.7g |
(2)该钢样中含碳量=1-98.2%=1.8%,0.6%<1.8%<2%,∴属于高碳钢;
(3)灼烧后钢样品时,碳生成二氧化碳使质量减小,同时铁与氧气生成铁的氧化物而使质量增大;钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物增加的质量;
故答案为:
(1)0.2;98.2%;(2)高碳钢;(3)钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物增加的质量.
点评:运用质量守恒定律,由实验记录的数据分析得出反应放出氢气的质量,为解答本题的基础,体现出运用知识分析问题的能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中.在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
则:反应中产生氢气 克,这种钢样品中铁的含量是多少?(精确到0.1%)
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
某化学兴趣小组用化学方法测定一种钢样品中铁的含量.同学们称取了11.3 g钢样品,投入装有20g稀盐酸(足量)的烧杯(烧杯质量为15g)中.在化学反应的过程中对烧杯(包括溶液和残余固体)进行了四次称量.记录如下表:
(1)反应中产生氢气 g,这种钢样品中铁的含量是多少?(精确到0.1%)
(2)钢的类型可分为:含碳量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是碳,则这种钢属于 .
(3)有同学提出:灼烧可使钢中的碳变为CO2而放出,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是 .
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量(g) | 46.3 | 46.1 | 45.9 | 45.9 |
(2)钢的类型可分为:含碳量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢.假设残留在烧杯中的黑色固体全部是碳,则这种钢属于
(3)有同学提出:灼烧可使钢中的碳变为CO2而放出,灼烧后钢样品质量会减轻.可是他们将一定量的钢样品灼烧后,发现质量反而增加了很多.原因是
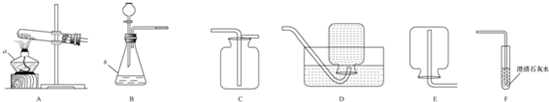
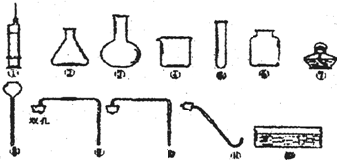 外校某化学兴趣小组同学学习化学积极性高,平时喜欢收集化学用品,建立了他们自己的实验室,其实验室中部分仪器如图.
外校某化学兴趣小组同学学习化学积极性高,平时喜欢收集化学用品,建立了他们自己的实验室,其实验室中部分仪器如图.