题目内容
3.废铁屑可与稀硫酸反应生成硫酸亚铁.若消耗质量分数为10%的稀硫酸49t,可制得硫酸亚铁固体多少吨?.分析 根据稀硫酸的质量和硫酸的质量分数,可以计算硫酸的质量;根据化学方程式可以计算生成硫酸亚铁的质量即可.
解答 解:废硫酸中H2SO4的质量为:49t×10%=4.9t,
设可生产硫酸亚铁的质量为x.
Fe+H2SO4=FeSO4+H2↑
98 152
4.9t x
$\frac{98}{4.9t}=\frac{152}{x}$
x=7.6t
答:可以生产7.6t硫酸亚铁.
点评 本题考查运用化学方程式进行计算的能力,比较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.如图是化学实验操作考查中,某些学生的实验操作示意图,其中正确的是( )
| A. |  取用锌粒 | B. |  过滤泥水 | C. |  加热铜片 | D. |  检验氧气 |
12.下列含有氧分子的物质是( )
| A. | 液氧 | B. | 二氧化硫 | C. | 氯酸钾 | D. | 双氧水 |
13.关于通电分解水的实验,下列说法中错误的是( )
| A. | 该实验证明水由氢气和氧气组成 | |
| B. | 生成的氢气和氧气的体积比为2:1 | |
| C. | 实验前加入少量氢氧化钠,增强水的导电性 | |
| D. | 通电分解9克水,可得到1克氢气、8克氧气 |
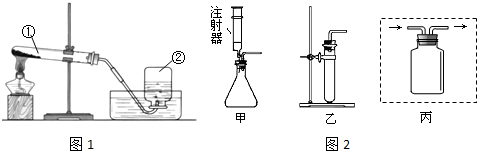

 常用实验室制取氧气的方法有:a.加热氯酸钾和二氧化锰粉末;b.加热高锰酸钾固体;c.用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生氧气.
常用实验室制取氧气的方法有:a.加热氯酸钾和二氧化锰粉末;b.加热高锰酸钾固体;c.用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生氧气.