题目内容
1.如图是一氧化碳与氧气反应的示意图:
(1)该反应属化合反应类型(化合、分解),其过程中变化的粒子是(填名称,下同)一氧化碳分子、氧分子,不变的粒子是碳原子、氧原子.
(2)一氧化碳具有的化学性质与二氧化碳的化学性质不同(填相同或不同),用分子原子点观点解释它们分子的构成不同,不同种的分子性质不同.
分析 (1)根据一氧化碳与氧气反应生成二氧化碳,化合化学反应的实质进行分析解答即可.
(2)根据一氧化碳与二氧化碳的化学性质,结合同种的分子性质相同,不同种的分子性质不同,进行分析解答.
解答 解:(1)一氧化碳与氧气反应生成二氧化碳,该反应符合“多变一”的特征,属于化合反应.
该变化是实质是一氧化碳分子和氧分子分成碳原子和氧原子,然后碳原子和氧原子结合成二氧化碳分子,其过程中变化的粒子是一氧化碳分子和氧分子;不变的粒子是碳原子和氧原子.
(2)一氧化碳具有可燃性,二氧化碳不能燃烧、不能支持燃烧,他们的化学性质不同;由于它们分子的构成不同,不同种的分子性质不同.
故答案为:(1)化合;一氧化碳分子;氧分子;碳原子;氧原子;(2)不同;它们分子的构成不同,不同种的分子性质不同.
点评 本题难度不大,掌握一氧化碳的化学性质、化学变化的实质等是正确解答本题的关键.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
12.2003年10月15日9时,神舟5号载人飞船由长征火箭发射升空,标志着中华民族的飞天梦想实现啦!火箭的推进剂是液氢和液氧,在此它们的作用分别是( )
| A. | 密度最小,供呼吸 | B. | 作燃料,助燃 | ||
| C. | 助燃,支持燃烧 | D. | 密度最小,作催化剂 |
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
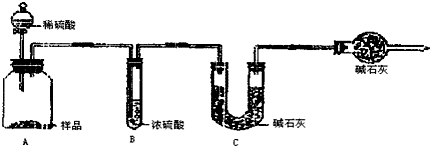
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.

甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
 默默同学在一个趣味实验活动中发现(如图):下列四组药品都能让装置上的气球鼓起来.
默默同学在一个趣味实验活动中发现(如图):下列四组药品都能让装置上的气球鼓起来.
 小明从菜场买了一斤鸡蛋,放入水中煮,发现有的鸡蛋壳会破裂有的不破裂.她想:蛋壳的抗裂强度与什么因素有关呢?
小明从菜场买了一斤鸡蛋,放入水中煮,发现有的鸡蛋壳会破裂有的不破裂.她想:蛋壳的抗裂强度与什么因素有关呢?