题目内容
1.晓蜂同学的化学笔记本上有如下记录,你认为不正确的是( )| A. | 化学反应发生时不一定能观察到明显的现象 | |
| B. | 酸碱中和反应生成盐和水,但是生成盐和水的反应不一定是中和反应 | |
| C. | 书写化学方程式的原则是以客观事实为依据,遵循质量守恒定律 | |
| D. | 一定温度下,向溶液中加入溶质都会使其溶质质量分数增大. |
分析 A、根据化学反应时的现象,进行分析判断.
B、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水.
C、根据书写化学方程式的原则,进行分析判断.
D、根据一定温度下,向溶液中加入溶质,不一定能溶解,进行分析判断.
解答 解:A、化学反应发生时不一定能观察到明显的现象,如稀盐酸与氢氧化钠反应生成氯化钠和水,反应无明显现象,故选项说法正确.
B、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项说法正确.
C、书写化学方程式的原则是以客观事实为依据,遵循质量守恒定律,故选项说法正确.
D、一定温度下,向溶液中加入溶质,若溶液为饱和溶液,加入的溶质不溶解,其溶质质量分数不变,故选项说法错误.
故选:D.
点评 本题难度不大,掌握中和反应的特征、化学变化的特征、书写化学方程式的原则等是正确解答本题的关键.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
12.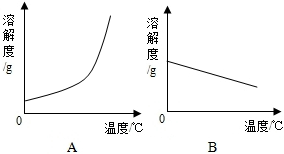 如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
(1)依据如表数据,绘制Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是A(填A或B).
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为9.1g.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙<甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
 如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为9.1g.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙<甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
16.化学与生活密切相关,下列说法正确的是( )
| A. | 利用溶解原理,洗洁精能洗去餐具表面的油污 | |
| B. | 察觉燃气泄漏要关闭阀门,开窗通风 | |
| C. | 铵态氮肥与熟石灰混合使用可以明显提高肥效 | |
| D. | 维生素B缺乏会引起夜盲症. |
6.下列有关物质分类正确的是( )
| A. | 鸡蛋、水果含有蛋白质 | B. | 液态氧属于氧化物 | ||
| C. | 纤维素属于合成材料 | D. | 甲烷属于有机物 |
13.下列对某一主题的知识归纳,全部正确的一组是( )
| A.水资源 | B.化学与健康 |
| 废水--生活污水直接排放 硬水和软水--可用肥皂水来检验 | 人体缺乏维生素B--引起坏血病 铁、锌、钙元素--都是人体必须的微量元素 |
| C.燃烧与灭火 | D.食品安全 |
| 用水灭火,可降低可燃物的着火点 | 工业酒精--含有甲醇等有毒物质,不能饮用 黄曲霉素(C17H12O6)--属于有机物,食用霉变 后含有黄曲霉素的食物可能诱发癌变 |
| A. | A | B. | B | C. | C | D. | D |
10.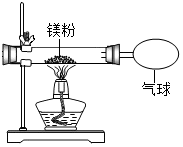 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
(1)小明发现燃烧产物的质量大干反应物镁条的质量,产生这一现象的原因空气中的氧气参加了化学反应.
(2)于是小明同学按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体.
③氮化镁可与水剧烈反应生成氨气,该气体能使湿润的红色石蕊试纸变蓝.
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想
[反思与交流]空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的Mg0却远多于Mg3N2,为什么呢?请给出合理的解释氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应.
(4)该兴趣小组又做了镁条与盐溶液反应的实验.发现均能产生H2.实验现象如表:
如表中,用水进行实验目的是对比.
根据如表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率 ②温度改变反应速率,因为升高温度可以加快产生气体的速率 ③升高温度能使反应更复杂,因为升高温度使镁与水反应的生成物在与盐反应生成氨气(NH3).
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)小明发现燃烧产物的质量大干反应物镁条的质量,产生这一现象的原因空气中的氧气参加了化学反应.
(2)于是小明同学按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体.
③氮化镁可与水剧烈反应生成氨气,该气体能使湿润的红色石蕊试纸变蓝.
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想
| 实验操作 | 实验现象及结论 |
(4)该兴趣小组又做了镁条与盐溶液反应的实验.发现均能产生H2.实验现象如表:
实验序号 | 实验1 | 实验2 | 实验3 | / |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
根据如表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率 ②温度改变反应速率,因为升高温度可以加快产生气体的速率 ③升高温度能使反应更复杂,因为升高温度使镁与水反应的生成物在与盐反应生成氨气(NH3).

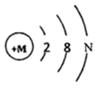 如图是某粒子的结构示意图.当M-N<10时,该 粒子属于阴离子(填“原子”“阴离子“或“阳离子“):该粒子带有2个单位的负电荷,则该粒子的符号是S2-.
如图是某粒子的结构示意图.当M-N<10时,该 粒子属于阴离子(填“原子”“阴离子“或“阳离子“):该粒子带有2个单位的负电荷,则该粒子的符号是S2-.