题目内容
10.元素周期表是学习和研究化学的重要工具,请分析图中的信息回答有关问题.
(1)3号元素在化学反应中易失去1个电子.
(2)17号元素形成的离子符号是Cl-.
(3)写出14号与9号元素组成化合物的化学式SiF4.
(4)适当补充碘元素能预防甲状腺疾病,请根据图2推断碘元素在周期表中位于第五周期.
分析 (1)根据原子结构来分析;
(2)根据离子符号的写法来分析;
(3)根据原子序数确定元素种类,然后根据化合物的化学式写法来分析;
(4)根据元素周期律来分析.
解答 解:(1)由3号元素锂原子的结构示意图可知,其原子核外最外层有1个电子,在化学反应中易失去最外层的1个电子;故填:1;
(2)17号元素是氯元素,其原子的最外层有7个电子,在化学反应中易得到一个电子形成带一个单位负电荷的氯离子;故填:Cl-;
(3)14号元素是硅,化合价常显+4价,9号元素是氟,化合价常显-1价,二者组成的化合物的化学式为SiF4;故填:SiF4;
(4)元素的周期数等于其原子核外的电子层数,由碘元素的原子结构示意图可知,碘元素位于第五元素,故填:五.
点评 本题主要考查对元素周期表的应用,较好地考查了学生观察、分析、解决问题的能力.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
5.下列表中的叙述、对应的化学方程式和所属反应类型都正确的是( )
| 叙述 | 化学反应方程式 | 反应类型 | |
| A | 拉瓦锡研究空气成分 | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2 | 分解反应 |
| B | 探究一氧化碳的还原性 | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | 置换反应 |
| C | 用二氧化碳制作碳酸饮料 | CO2+H2O═H2CO3 | 化和反应 |
| D | 服用含氢氧化铝的药物治疗胃酸过多 | Al(OH)3+3HCl═AlCl3+3H2O | 复分解反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
15.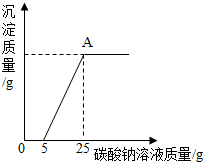 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的$\frac{1}{4}$于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为80%.
(2)编号③所用稀盐酸的质量m为100g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 25g | 50g | m(80<m<150) | 150g |
| 剩余固体的质量 | 7.5g | 5g | 2g | 2g |
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为80%.
(2)编号③所用稀盐酸的质量m为100g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
2.以下实验操作正确的是( )
| A. |  加入块状固体 | B. |  加热液体 | C. |  读取液体体积 | D. |  稀释浓硫酸 |
19.下列叙述不正确的是( )
| A. | 可用食醋除去热水瓶中的水垢 | B. | 在铁桶中较长时间配制硫酸铜溶液 | ||
| C. | 可用稀硫酸除去铁锈 | D. | 可用消石灰改良酸性土壤 |
2.金属材料在生产、生活中应用广泛.化学小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动.
【作出猜想】对Mn的活动性提出了三种猜想:
猜想一、Mn>Fe>Cu;猜想二、Fe>Mn>Cu;猜想三、Fe>Cu>Mn.
【实验验证】
已知Mn在生成物中的化合价均为+2价,则步骤②中反应的化学方程式为:Mn+FeSO4=MnSO4+Fe.
【拓展延伸】将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌,过滤(填操作名称),得到固体X和溶液Y.则:
(1)溶液Y中溶质的成分BC(填序号).
A.一定有FeSO4 B.一定有MnSO4 C.可能有H2SO4 D.可能有CuSO4
(2)得到固体X和溶液Y的操作过程中,用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流.
【反思与应用】活动性越强的金属,越容易在空气中发生化学变化.世界上每年因锈蚀而报废的金属设备和材料,高达产量的205-40%.铁生锈的条件是铁与空气中的氧气、水发生化学反应;防止铁生锈是保护金属资源的一种有效途径,请写出一条防止铁生锈的措施喷漆.
【作出猜想】对Mn的活动性提出了三种猜想:
猜想一、Mn>Fe>Cu;猜想二、Fe>Mn>Cu;猜想三、Fe>Cu>Mn.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别向盛有Mn、Fe、Cu三种金属的三支试管中加入同体积、同浓度的稀硫酸. | 盛有Mn、Fe的试管内都有气泡产生,锰片的反应比铁片的反应剧烈,盛有Cu的试管中没有产生气泡. | 猜想三错误. |
| ②向盛有硫酸亚铁溶液的试管中加入金属Mn. | 有黑色固体析出. | 猜想一正确. |
【拓展延伸】将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌,过滤(填操作名称),得到固体X和溶液Y.则:
(1)溶液Y中溶质的成分BC(填序号).
A.一定有FeSO4 B.一定有MnSO4 C.可能有H2SO4 D.可能有CuSO4
(2)得到固体X和溶液Y的操作过程中,用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流.
【反思与应用】活动性越强的金属,越容易在空气中发生化学变化.世界上每年因锈蚀而报废的金属设备和材料,高达产量的205-40%.铁生锈的条件是铁与空气中的氧气、水发生化学反应;防止铁生锈是保护金属资源的一种有效途径,请写出一条防止铁生锈的措施喷漆.
 根据如图中A、B、C三种物质(均不含结晶水)的溶解度曲线,回答下列问题:
根据如图中A、B、C三种物质(均不含结晶水)的溶解度曲线,回答下列问题: