题目内容
3.将氧化铜和炭粉混合均匀后,称取100g置于试管中.在隔绝空气的情况,对试管中的混合物加热至高温,充分反应冷却后,称得试管中残留固体为78g,则混合物中氧化铜和炭粉的质量比为1:4或3:47.分析 碳与氧化铜反应生成铜的二氧化碳,由质量守恒定律,试管中减少的质量即为生成二氧化碳的质量,由反应的化学方程式列式计算出参加反应的碳和氧化铜的质量,进而计算出混合物中氧化铜和炭粉的质量比.
解答 解:由质量守恒定律,生成二氧化碳的质量为100g-78g=22g.
设参加反应的碳和氧化铜的质量分别是x、y
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
12 160 44
x y 22g
$\frac{12}{44}=\frac{x}{22g}$ x=6g
$\frac{160}{44}=\frac{y}{22g}$ y=80g
完全反应后试管中剩余的反应物可能是碳或氧化铜,剩余的质量为100g-6g-80g=14g.
则混合物中氧化铜和炭粉的质量比可能为(14g+6g):80g=1:4,也可能为6g:(80g+14g)=3:47.
故答案为:1:4;3:47.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
13.难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
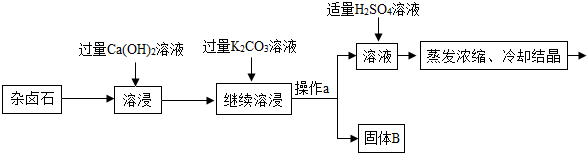
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的硫酸镁;发生反应的化学方程式是MgSO4+Ca(OH)2=CaSO4+Mg(OH)2↓.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2↓、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
①上述实验的数据中,温度与K+浸取率的关系是温度越高,浸取率越大.
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.

(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的硫酸镁;发生反应的化学方程式是MgSO4+Ca(OH)2=CaSO4+Mg(OH)2↓.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2↓、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
| 实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
| a | 25 | 2.5 | 72.4 |
| b | 40 | 2.5 | 86.55 |
| c | 40 | 3 | 90.02 |
| d | 60 | 3 | 91.98 |
| e | 60 | 4 | 91.45 |
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.
5.小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的.他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动.
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液…铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【预 测】三种金属在金属活动性顺序中的相对位置关系:①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
【回答问题】
(1)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是Cr、Al都比Cu活泼.
(2)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是Al、Cu、CrSO4.
【归 纳】(3)比较金属活动性强弱的方法有①金属跟酸反应②金属跟盐溶液反应③金属与氧气反应.
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液…铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【预 测】三种金属在金属活动性顺序中的相对位置关系:①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
【回答问题】
(1)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是Cr、Al都比Cu活泼.
| 实验一 | 实验二 | 实验三 | |
| 实验方案 | 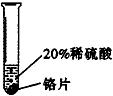 |  | 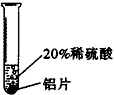 |
| 实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色 | 无现象 | 铝片表面产生气泡较快 |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是Al、Cr、Cu(或“②”). | |||
【归 纳】(3)比较金属活动性强弱的方法有①金属跟酸反应②金属跟盐溶液反应③金属与氧气反应.
12.下列变化属于化学变化的是( )
| A. | 滴水成冰 | B. | 自制甜酒酿 | C. | 干冰升华 | D. | 海水晒盐 |
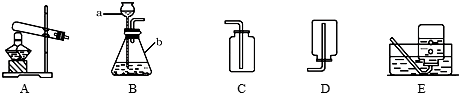
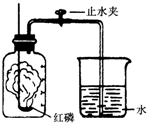 某同学设计了测定空气中氧气含量的实验,实验装置如图,实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图,实验步骤如下: