题目内容
 为测定某大理石样品中碳酸钙的质量分数,取该样品10g,加入足量的10%盐酸,产生CO2的物质的量与时间的关系如图所示(杂质不含碳元素).
为测定某大理石样品中碳酸钙的质量分数,取该样品10g,加入足量的10%盐酸,产生CO2的物质的量与时间的关系如图所示(杂质不含碳元素).①该样品中碳酸钙的质量分数.(根据化学方程式列式计算)
②若取该样品10g,充分煅烧,最多可以产生CO2
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
碳酸钙受热分解生成氧化钙和二氧化碳.
碳酸钙受热分解生成氧化钙和二氧化碳.
解答:解:①设碳酸钙的质量为x,
生成二氧化碳的质量为:44g/mol×0.07mol=3.08g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.08g
=
,
x=7g,
该样品中碳酸钙的质量分数为:
×100%=70%,
答:该样品中碳酸钙的质量分数为70%.
②因为两个反应中,碳酸钙中的铁元素完全转化成二氧化碳,所以若取该样品10g,充分煅烧,最多可以产生3.08g二氧化碳.
故填:3.08.
生成二氧化碳的质量为:44g/mol×0.07mol=3.08g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.08g
| 100 |
| x |
| 44 |
| 3.08g |
x=7g,
该样品中碳酸钙的质量分数为:
| 7g |
| 10g |
答:该样品中碳酸钙的质量分数为70%.
②因为两个反应中,碳酸钙中的铁元素完全转化成二氧化碳,所以若取该样品10g,充分煅烧,最多可以产生3.08g二氧化碳.
故填:3.08.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
某物质M是SO2、SO3、O2的混合物,其中硫元素的质量分数为40%,则这三种物质的质量比可能是( )
| A、8:7:2 |
| B、8:10:3 |
| C、4:5:2 |
| D、3:5:2 |
一密闭容器中有A,B,C三种物质,加热充分反应后有D物质生成,各物质变化前后的质量如下表所示:
已知A,B,C,D四种物质的相对分子质量分别为16、32、44、18,则发生的化学反应的化学方程式可表示为( )
| 物质 质量 | A | B | C | D |
| 反应前质量/g | 16 | 16 | 16 | 0 |
| 反应后质量/g | 12 | 0 | 27 | 待测 |
| A、2A+B═C+2D |
| B、A+2B═C+2D |
| C、2A+B═2C+D |
| D、A+B═C+D |
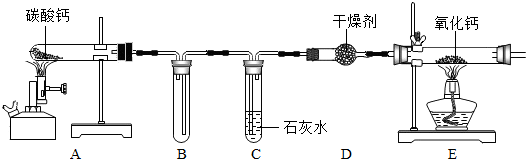
 实验室制取氧气时,某同学取质量为x的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图1所示,请回答下列问题:
实验室制取氧气时,某同学取质量为x的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图1所示,请回答下列问题: 如图所示,用已经验纯的CO进行实验,开始实验时应先
如图所示,用已经验纯的CO进行实验,开始实验时应先