题目内容
9. 老师拿出一瓶没有瓶盖的氢氧化钠固体取出50g样品实验如图,请同学们进行分析:(如图所示)
老师拿出一瓶没有瓶盖的氢氧化钠固体取出50g样品实验如图,请同学们进行分析:(如图所示)(1)计算50g样品中氢氧化钠的质量分数;
(2)分析氢氧化钠变质的原因CO2+2NaOH═Na2CO3+H2O
(3)若要提纯这瓶氢氧化钠,可以采取的方法是加入适量的氢氧化钙溶液,过滤.
分析 (1)根据碳酸钠与盐酸反应的方程式,由生成的二氧化碳的质量可算出盐酸溶液的溶质的质量分数;再根据与氢氧化钠反应的化学方程式求出氢氧化钠的质量即可计算出50g样品中氢氧化钠的质量分数;
(2)根据氢氧化钠与二氧化碳的反应分析回答;
(3)根据氢氧化钠变质后生成的碳酸钠的性质分析回答.
解答 解:(1)由图象可知,与碳酸钠反应的稀盐酸的质量为:200g-150g=50g;
设50g的稀盐酸中溶质的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 2.2g
$\frac{73}{44}=\frac{x}{2.2g}$ 解得:x=3.65g
稀盐酸中溶质的质量分数为:$\frac{3.65g}{50g}×100%$=7.3%
由图象可知,与氢氧化钠反应的稀盐酸的质量为150g,溶质的质量为:150g×7.3%=10.95g
设50g样品中氢氧化钠的质量为y
HCl+NaOH=NaCl+H2O
36.5 40
10.95g y
$\frac{36.5}{40}=\frac{10.95g}{y}$ 解得:y=12g
50g样品中氢氧化钠的质量分数是:$\frac{12g}{50g}×100%$=24%
(2)氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠和水,反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O;
(3)氢氧化钠变质后有生成的碳酸钠,碳酸钠能与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以提纯这瓶氢氧化钠,可以采取的方法是:加入适量的氢氧化钙溶液,过滤.
故答为:(1)50g样品中氢氧化钠的质量分数是24%;(2)CO2+2NaOH═Na2CO3+H2O;(3)加入适量的氢氧化钙溶液,过滤.
点评 本题主要考查了根据化学方程式的计算,了解氢氧化钠、碳酸钠的性质是解答本题的基础知识.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 黄铜片和纯铜片:相互刻划比较硬度 | |
| B. | 棉线和羊毛线:灼烧后闻气味 | |
| C. | 硫酸铵固体和氯化铵固体:加熟石灰混合研磨后闻气味 | |
| D. | 氢氧化钠固体和硝酸铵固体:加水溶解后测温度 |

(1)图中仪器名称是②锥形瓶,⑧集气瓶.
(2)小宝同学用氯酸钾和二氧化锰制取并收集一瓶氧气,应选择上图中的仪器①④⑤⑨(或①④⑥⑦)
(填序号,下同),其化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;验证瓶中氧气已集满的方法是将带火星的木条放到瓶口,如果木条复燃,则已收满.
(3)小茹同学用锌和稀硫酸制取H2,同时生成硫酸锌,则应选择上图中②③⑥⑦装置.
(4)小佳同学查阅资料得到制取硫化氢气体的如下信息,请回答下列问题:
| 气体 | 实验药品 | 反应条件 | 气体物理性质 |
| H2S | 硫化亚铁固体与稀硫酸 | 不需加热 | 无色,密度比空气大,可溶于水 |
②制取硫化氢可以采用装置②和③,理由是反应物是固体和液体,且反应不需要加热.
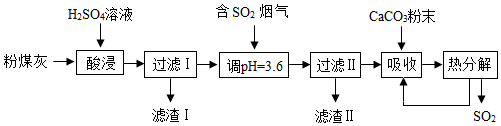
查阅资料:①SO2易溶于水,且能与水反应生成H2SO3
②+4价的硫元素具有还原性,易被氧气等物质氧化为+6硫元素
③不同溶液PH值时铝元素的存在形式如下表
| PH值 | 0-5.5 | 5.5-8 | 8-14 |
| 存在形式 | Al3+ | Al(OH)3 | AlO2- |
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x.滤渣Ⅱ的主要成分为CaSO4(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是铝离子转化为氢氧化铝而沉淀.
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是被氧气氧化为+6价成为硫酸;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将减小(填“增大”、“减小”或“不变”).
| 温度(℃) | 20 | 40 | 50 | 60 | 80 | |
| 溶解度(g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
| NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
| KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
②50℃时,100g水中最多溶解NaCl36.6g.
③A是80℃含有120g水的KNO3溶液.经过如下操作,得到102gKNO3固体.

(1)A溶液为不饱和(选填“饱和”或“不饱和”)溶液.
(2)对以上过程的分析,正确的是AC(选填编号).
A、A到B的过程中,溶质质量没有改变 B、B中溶质与溶剂的质量比为 169:100
C、开始析出KNO3固体的温度在60℃至80℃之间 D、A溶液的质量等于222g.
| 物质 | 杂质 | 除杂所用的试剂和方法 | |
| A | 氮气 | 氧气 | 木条,点燃 |
| B | 稀硫酸 | 稀盐酸 | 加入适量的硝酸银溶液,过滤 |
| C | 氢氧化钠溶液 | 氢氧化钡溶液 | 加入适量的碳酸钠溶液、过滤 |
| D | 氯酸钾 | 氯化钾 | 加入少量二氧化锰,加热 |
| A. | A | B. | B | C. | C | D. | D |

 下列物质用于实验室制取气体,可以直接采用如图所示装置的是C
下列物质用于实验室制取气体,可以直接采用如图所示装置的是C