��Ŀ����
8��ij�о���Ա����ͼ��ʾ���̽��С�ȼú�����������о�����ʵ���У���һ���Էֱ�����Ӧװ���м���ˮ������Ȼ������ͨ��CO2��SO2��O2������壬��ӦҺ���ѭ�����������������ڷ�Ӧװ������ѭ������ķ�ӦҺ���Ϸ�Ӧ���������ѭ���Ժ����ķ�ӦҺ�������Ʊ�FeSO4•7H2O��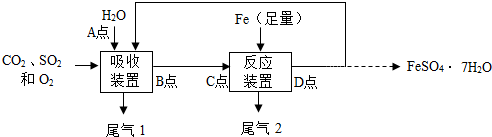
��1������װ�õ��¶Ȳ��˹��ߣ�ԭ�����¶ȹ��ߣ�������ܽ���½��������ڷ�Ӧ�Ľ��У���װ�����ܷ�Ӧ�Ļ�ѧ����ʽΪ2SO2+2H20+O2=2H2SO4��
��2����Ӧװ�õ��¶ȿ�����40�����ң����еķ�Ӧ��ѧ����ʽΪFe+H2SO4=FeSO4+H2������ʱ���ӿ�÷�Ӧ���ʿɲ�ȡ�Ĵ�ʩ�н��裨����ø�ϸ�����ۣ���д��һ�ּ��ɣ���
��3��ʵ���У��Ե�һ��ѭ���з�ӦҺ��pH��ABD������и��ټ�⣬ABD����pH��С����Ĵ���ΪBDA��������ѭ���е�����ɢʧ��CD�������¶ȸߵ���D�㣮
��4���������ѭ���Ժ���ӦҺ��������ȴ�ᾧ�����ˡ�ϴ��������T���Ƶ�FeSO4•7H2O��
��5�����������д��������ɸĽ�����һ�Ƿ������ã����ǿ�����β��1��β��2��һ�������´��ϳɼ״�CH4O��ͬʱ��H2O���ɣ����÷�Ӧ�Ļ�ѧ����ʽΪCO2+3H2$\frac{\underline{\;����\;}}{\;}$CH4O+H2O��
���� ��1������������ܽ�����¶ȵ����߶����ͷ�����д����Ӧ�ķ���ʽ��
��2�����ݷ�ӦҺ�ijɷ�����������۷�Ӧд����Ӧ�ķ���ʽ�����������Ӧ��ĽӴ������ʹ��Ӧ�ӿ죻
��3�����ݸ���ijɷַ�����Һ��pH�����ݷ�Ӧ���������ı仯�����¶ȸߵͣ�
��4�����ݷ�������ķ��������������裻
��5�����ݷ�Ӧ���ص���ȼ���д����ʽ�IJ���д����Ӧ�ķ���ʽ��
��� �⣺��1���¶ȹ��ߣ�������ܽ���½��������ڷ�Ӧ�Ľ��У��������װ�õ��¶Ȳ��˹��ߣ�����¶ȹ��ߣ�������ܽ���½��������ڷ�Ӧ�Ľ��У�
��2����Ӧװ���в��������������Ӧ��������������������Ҫ�ӿ췴Ӧ���Խ��н��裨����ø�ϸ�����ۣ������Fe+H2SO4=FeSO4+H2�������裨����ø�ϸ�����ۣ���
��3��A���Ǵ�ˮ�����pH=7��B����������Һ�����pH��7��D����ܴ���Ϊ��ȫ��Ӧ�����ᣬ���pH��������Ȼ��7�����ABD����pH��С����Ĵ���ΪBDA��D�����������ᷴӦ����Һ����Ӧ���ȣ�����¶Ȼ����ߣ���D����¶ȸ���C�㣻���BDA��D��
��4�����ڷ�Ӧ���ȣ���˿���ͨ����ȴ���µķ���ʹ���������ᾧ������Ȼ��ͨ�����˵õ����壻�����ȴ�ᾧ�����ˣ�
��5�����ڷ�Ӧ���ȣ���˿��Խ��з��Ȼ������ã�β��1�ijɷ��Ƕ�����̼��β��2�ijɷ���������������̼��������һ�������´��ϳɼ״�CH4O��ͬʱ��H2O���ɣ���˷�Ӧ�ķ���ʽΪ��CO2+3H2$\frac{\underline{\;����\;}}{\;}$CH4O+H2O������������ã�CO2+3H2$\frac{\underline{\;����\;}}{\;}$CH4O+H2O��
���� ����Ϊ��Ϣ��Ŀ��飬�漰�˷�Ӧ���ʡ������غ㶨�ɡ���ѧ������ȵĿ��飬�ܹ�����ѧ���ķ��������������ѶȽϴ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ���������� | B�� | һ����̿�� | C�� | һ��������ͭ | D�� | һ���ж������� |
| A�� | һ����̪������20��̼ԭ�ӡ�14����ԭ�Ӻ�4����ԭ�ӹ��� | |
| B�� | ��̪��Һ�оƾ�����ζ�������̪��Һ�Ƿ�̪�����Ҵ����γɵ� | |
| C�� | ��̪����Ԫ�ص�������������ʽ��$\frac{14}{318}$��100% | |
| D�� | �ڡ������˶������ʵ�顱�У���̪������ɢ����ˮ�У�ʹ��ˮ���ɫ |
 ���и������ʼ�ͨ��һ����Ӧ����ʵ����ͼת�����ǣ�������
���и������ʼ�ͨ��һ����Ӧ����ʵ����ͼת�����ǣ�������| X | Y | Z | |
| A | Ca��OH��2 | CaCO3 | CaO |
| B | AgNO3 | Ba��NO3��2 | BaSO4 |
| C | Cu | CuO | CuCl2 |
| D | Fe2O3 | Fe | FeCl2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
| �� ���� | I A | ��A | ��A | ��A | VA | ��A | ��A | 0 |
| 3 | 11 Na �� 22.99 | 12 Mg þ 24.31 | 13 Al �� 26.98 | 14 Si �� 28.09 | 15 P �� 30.97 | 16 S �� 32.06 | 17 Cl �� 35.45 | 18 Ar � 39.95 |
��2������ϱ��в�����ڹ�Ԫ�ص�һ����Ϣ����ԭ�Ӻ���������Ϊ14����Ԫ�����ڷǽ���Ԫ�صȣ���
��3����3���У����ڣ������ڽ���Ԫ�ص����ƣ���þ����������һ�֣�����Ԫ�ص�������Cl-�γɵĻ�����Ļ�ѧʽΪNaCl����MgCl2��AlCl3����
