题目内容
工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:

|
|
|
②2NO +O2 === 2NO2
③3NO2+H2O === 2HNO3 + NO
(1)上述反应涉及的物质中,属于氧化物的有____种。
(2)反应②的基本反应类型为 。
(3)制取硝酸过程中可循环使用的物质是 。
(3分) (1)3 (1分) (2)化合反应 (1分) (3)NO(1分)

 走进文言文系列答案
走进文言文系列答案科学探究中常用到推理的方法。根据下列实验事实推出结论正确的是
| 编号 | 实验事实 | 实验结论 |
| A | 某溶液使酚酞溶液变红 | 该溶液一定是NaOH溶液 |
| B | 某物质中含有一种元素 | 该物质一定是单质 |
| C | 常温下,测定某溶液的PH=3 | 该溶液一定呈酸性 |
| D | 某气体不能使带火星的木条复燃 | 该气体一定不含氧气 |
用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色。实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究。
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁。
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是________。
【查阅资料】
① 碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O。
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可)。
【进行实验】
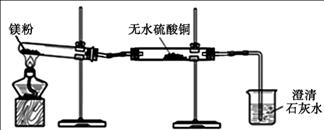
(1)同学们用久置的镁粉进行了如下实验。
| 实 验 装 置 |
|
| 实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
| 结 论 | 久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上。
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失。请写出有气体生成的一个反应化学方程式________。
②将实验①试管中的混合物进行______ _(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热。黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质。
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁。
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是_____________。