��Ŀ����
��ͼ��Ԫ�����ڱ��е�һ���֣���Ԫ�����ڱ��У�ͬһ���ڣ����У��е�Ԫ�أ���0�壨�������У�Ԫ���⣬������ԭ�������������࣬ԭ�Ӱ뾶��С���ڻ�ѧ��Ӧ �У�ԭ��ʧ���������������õ�����������ǿ��

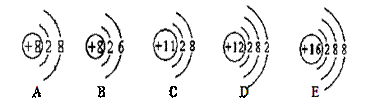
��ش�
��1��������ԭ������Ϊ������ԭ������Ϊ8��Ԫ��λ��Ԫ�����ڱ��ĵ��������ڣ�Ԫ�ط���Ϊ���������������� ����������ǽ�������Ԫ�أ�
��2������Ԫ�ػ�ѧ�������Ƶ�Ԫ��Ϊ������
��3�������ϱ��ɷ��֣�ÿһ����Ԫ�ش���������������ѭ��һ��������������
�����㡿Ԫ�����ڱ����ص㼰��Ӧ�ã�
��ר�⡿��ѧ����������غ㶨�ɣ�
��������������Ԫ�����ڱ��У���ԭ�������ĵ�����ԭ�ӽṹ�е��Ӳ������������������������Եı仯��Ԫ�ص����ࣨ�������ǽ�����ϡ�����壩��Ԫ�����ʣ�Ҳ���������Եı仯������⣮
����𡿽⣺��1����Ԫ�����ڱ��пɲ�ù�����ԭ������Ϊ28.09���ɲ��ԭ������Ϊ8��Ԫ��λ��Ԫ�����ڱ��ĵ� 2���ڣ�Ԫ�ط���Ϊ O�����ڷǽ�������2������Ԫ�����ڱ��Ĺ���������������ͬ��Ԫ�ػ�ѧ�������ƣ�
��3����Ԫ�����ڱ��У�ͬһ���ڣ����У��е�Ԫ�أ���0�壨�������У�Ԫ���⣬������ԭ�������������࣬ԭ����������������ȣ�
�𰸣���1��28.09 2 O �ǽ���
��2���
��3��ÿһ���У�������������
�����������⿼����ѧ������Ԫ�����ڱ��Ĺ��ɺ�������Ϣȥ����������
��

������Һ�������д�±�
| �� Һ | ʯ��ˮ | ����ˮ | �� �� | ϡ���� |
| �� �� | ||||
| �� �� |
��ҵ���ð�����NH3����ȡ���ᣨHNO3������ҵ����Ϊ��

|
|
|
��2NO +O2 === 2NO2
��3NO2+H2O === 2HNO3 + NO
��1��������Ӧ�漰�������У��������������____�֡�
��2����Ӧ�ڵĻ�����Ӧ����Ϊ ��
��3����ȡ��������п�ѭ��ʹ�õ������� ��