题目内容
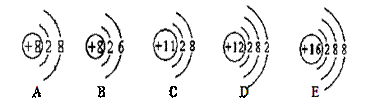
小明发现月饼盒里的脱氧剂部分呈红褐色,査阅资料得知脱氧剂中含有铁粉和活性炭.他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe.其中猜想合理的是( )
A.①③⑤ B.②④⑤ C.②⑤ D.④⑤
【考点】食品干燥剂、保鲜剂和真空包装的成分探究.
【专题】压轴实验题;科学探究.
【分析】根据质量守恒定律进行分析猜想,铁粉生锈成红褐色,活性炭具有吸附性,化学性质稳定.
【解答】解:由题意可知,脱氧剂中含有铁粉和活性炭.在脱氧时,活性炭具有吸附性,化学性质稳定;铁粉与氧气、水反应生成锈,呈红褐色,铁锈的主要成分是Fe2O3.如果铁全部生成了铁锈,这包脱氧剂中只有Fe2O3和C;若果铁粉部分生成铁锈,这包脱氧剂中Fe2O3、C和Fe.
A、脱氧剂中 含有铁粉和活性炭,由质量守恒定律可知,脱氧后的物质中不可能含有铜,故A错误;
含有铁粉和活性炭,由质量守恒定律可知,脱氧后的物质中不可能含有铜,故A错误;
B、由铁生锈可知,锈的主要成分是Fe2O3、不是Fe3O4,故B错误;
C、由脱氧剂的脱氧情况可知,②⑤猜想合理.故C正确;
D、由锈的主要成分是Fe2O3可知,这包脱氧剂中不可能含有Fe3O4,故D错误.
故选:C.
【点评】解答本题的关键是利用质量守恒定律及铁锈的主要成分进行分析、判断.

根据溶液的组成填写下表
| 溶 液 | 石灰水 | 蔗糖水 | 碘 酒 | 稀硫酸 |
| 溶 质 | ||||
| 溶 剂 |
工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:

|
|
|
②2NO +O2 === 2NO2
③3NO2+H2O === 2HNO3 + NO
(1)上述反应涉及的物质中,属于氧化物的有____种。
(2)反应②的基本反应类型为 。
(3)制取硝酸过程中可循环使用的物质是 。
甲乙丙丁四种物质混合后,在一定的条件下充分反应,测得反应前后各物质的质量分数如下表所示。说法正确的是( )
| 甲 | 乙 | 丙 | 丁 | |
| 反应前质量分数/% | 70 | 15 | 6.25 | 8.75 |
| 反应后质量分数/% | 35 | 7.5 | 48.75 | 8.75 |
A.丁一定是这个反应的催化剂 B.参加反应的甲和乙的质量之和一定等于生成的丙的质量
C.甲一定是化合物,乙一定是单质 D.该反应可能是分解反应
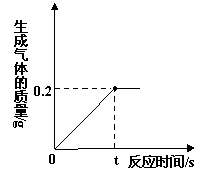 (1)完全反应后生成氢气的质量为 g。
(1)完全反应后生成氢气的质量为 g。