题目内容
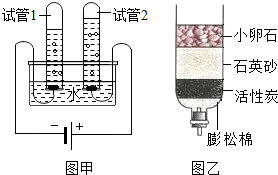
18. A~Z是初中化学常见的物质,其中A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,它们之间能发生如下变化,反应⑥是实验室制备E的常用方法(图中略去部分反应的产物).试回答:
A~Z是初中化学常见的物质,其中A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,它们之间能发生如下变化,反应⑥是实验室制备E的常用方法(图中略去部分反应的产物).试回答:(1)A的化学式O2;B的一种用途冶炼金属;W的俗称生石灰.
(2)写出下列化学方程式:④H2O+CaO=Ca(OH)2;⑦CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
分析 根据A~Z是初中化学常见的物质,A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,A和C、D反应都会生成水,所以A是氧气,D是氢气,C是甲烷,甲烷和氧气反应生成水和二氧化碳,所以E是二氧化碳,B是一氧化碳,反应⑥是实验室制备E的常用方法,所以Y是碳酸钙,Z是盐酸,水和W反应会生成X,所以W是氧化钙,X是氢氧化钙,碳酸钙高温会生成氧化钙和二氧化碳,然后将推出的物质进行验证即可.
解答 解:(1)A~Z是初中化学常见的物质,A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,A和C、D反应都会生成水,所以A是氧气,D是氢气,C是甲烷,甲烷和氧气反应生成水和二氧化碳,所以E是二氧化碳,B是一氧化碳,反应⑥是实验室制备E的常用方法,所以Y是碳酸钙,Z是盐酸,水和W反应会生成X,所以W是氧化钙,X是氢氧化钙,碳酸钙高温会生成氧化钙和二氧化碳,经过验证,推导正确,所以A是O2,B是一氧化碳,可以用来冶炼金属,W是氧化钙,俗称生石灰;
(2)④是氧化钙和水反应生成氢氧化钙,化学方程式为:H2O+CaO=Ca(OH)2,
⑦是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故答案为:(1)O2,冶炼金属,称生石灰;
(2)H2O+CaO=Ca(OH)2,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.化学学习让我们有了很多收获,下列归纳总结完全正确的一组是( )
| 选项 | 实验目的 | 方案 |
| A | 鉴别稀盐酸和稀硫酸 | 取样,滴加紫色石蕊,观察现象 |
| B | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、过滤、蒸发 |
| C | 除去CaO中的CaCO3 | 高温加热到固体质量不变 |
| D | 探究Mg、Ag、Cu金属的 活动性顺序 | 将两根光亮的镁条分别伸入 硫酸铜溶液和硝酸银溶液中 |
| A. | A | B. | B | C. | C | D. | D |
15.A、在宏观、微观和符号之间建立联系是化学学科的特点.
甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于表:
(1)请你画出丁物质的微观示意图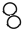 ;
;
(2)构成甲物质的粒子是水分子;
(3)四种物质中属于氧化物的是CO、H2O(填化学式),请你从微观角度描述判断的依据:均由同种分子构成,且分子又都是由氧原子和另一种原子构成的.
甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于表:
| 物质 | 甲 | 乙 | 丙 | 丁 | 图例: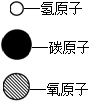 |
| 化学式 | H2O | C | ? | H2 | |
| 微观示意图 |  |  |  | ? |
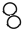 ;
;(2)构成甲物质的粒子是水分子;
(3)四种物质中属于氧化物的是CO、H2O(填化学式),请你从微观角度描述判断的依据:均由同种分子构成,且分子又都是由氧原子和另一种原子构成的.
10.工业上用电解饱和食盐水的方法来制取烧碱,将制得的烧碱溶液再经浓缩、蒸发等操作制成烧碱固体.在生产过程中,原料通常不能完全转化.另外,如果烧碱固体长时间存放在仓库里,也可能会变质.
(1)电解饱和食盐水制得烧碱的同时,还生成氯气和另一种气体,该反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)现从仓库中取来烧碱样品,该样品除了可能含有纯碱杂质外,还可能含有氯化钠杂质.某化学小组决定探究样品中是否含有这两种杂质.
①查阅资料:实验中若产生微溶物质,通常会以沉淀形式存在.
②实验设计
③交流与反思
a.烧碱固体长时间在仓库存放会变质的原因是(用化学反应方程式表示)2NaOH+CO2=Na2CO3+H2O.
b.实验后若测得废液的pH<7,则废液呈酸性(填“酸性”、“中性”或“碱性”),从操作简单和经济环保的角度考虑,应向废液中加入稍过量的石灰石,然后再倒入下水道中.
(1)电解饱和食盐水制得烧碱的同时,还生成氯气和另一种气体,该反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)现从仓库中取来烧碱样品,该样品除了可能含有纯碱杂质外,还可能含有氯化钠杂质.某化学小组决定探究样品中是否含有这两种杂质.
①查阅资料:实验中若产生微溶物质,通常会以沉淀形式存在.
②实验设计
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| a.取少量样品于试管中,并加入过量的稀硝酸. | 有气泡生成. | 样品中有纯碱. |
| b.再向步骤Ⅰ中所得的溶液加入硝酸银溶液. | 有白色沉淀生成. | 样品中有氯化钠. |
a.烧碱固体长时间在仓库存放会变质的原因是(用化学反应方程式表示)2NaOH+CO2=Na2CO3+H2O.
b.实验后若测得废液的pH<7,则废液呈酸性(填“酸性”、“中性”或“碱性”),从操作简单和经济环保的角度考虑,应向废液中加入稍过量的石灰石,然后再倒入下水道中.
7.下列应用和相应的原理(用化学方程式表示)及基本反应类型正确的是( )
| 选项 | 物质的应用 | 化学方程式 | 反应类型 |
| A | 电解水 | 2H202$\frac{\underline{\;通电\;}}{\;}$2H20+02↑ | 分解反应 |
| B | 向烧碱溶液中通人CO2 | 2NaOH+C02═Na2C03+H20 | 复分解反应 |
| C | 溶洞的形成 | CaC03+H20+C02═Ca(HC03)2 | 化合反应 |
| D | 比较铜和银的活动性 | Cu+AgN03═Cu(NO3)2+Ag | 置换反应 |
| A. | A | B. | B | C. | C | D. | D |
8. 在元素周期表中,应用于计算机的硅元素如图所示.下列有关硅的说法正确的是( )
在元素周期表中,应用于计算机的硅元素如图所示.下列有关硅的说法正确的是( )
 在元素周期表中,应用于计算机的硅元素如图所示.下列有关硅的说法正确的是( )
在元素周期表中,应用于计算机的硅元素如图所示.下列有关硅的说法正确的是( )| A. | 原子的质子数是14 | B. | 原子个数是14 | ||
| C. | 相对原子质量是14 | D. | 原子的质量是28.09 |