题目内容
13.下列做法正确的是( )| A. | 把实验剩余的药品倒入废液缸 | |
| B. | 用药匙取用食用盐,再用同一药匙直接取用碳酸钠粉末 | |
| C. | 取用较多量液体药品时,可直接向试管中倾倒 | |
| D. | 向试管中倾倒液体时,试管要直立 |
分析 A、做实验时剩余药品不能随意丢弃,要放入教师指定容器中,据此分析判断;
B、根据药匙使用的注意事项分析判断;
C、根据液体药品取用的方法分析判断;
D、根据液体药品取用的方法分析判断.
解答 解:A、做实验时剩余的药品不能随意丢弃,不能带出实验室、不能放回原瓶,要放到教师指定的容器中,故A不正确;
B、用药匙取用药品后要用洁净的纸将药匙擦干再去取用另一种药品,以免污染药品,故B不正确;
C、取用较多量液体药品时,可用试剂瓶向试管中直接倾倒,故C正确;
D、向试管中倾倒液体药品时,试管要倾斜,故D不正确;
故答案为C.
点评 此题考查常见的固体药品取用和液体药品取用,属于基础考查,掌握相应的操作方法,养成良好的操作习惯是顺利进行实验和进一步学好化学的基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.某同学开始时视线与量筒内凹液面的最低处相平读数为20mL,倒出一部分液体后,俯视读取剩余液体为12mL,那么他所倒出液体体积为( )
| A. | 大于8mL | B. | 小于8mL | C. | 等于8mL | D. | 无法确定 |
4.下列盐不能用金属与稀酸直接反应制得是( )
| A. | MgCl2 | B. | FeCl3 | C. | FeSO4 | D. | AlCl3 |
1.除去下列物质中的少量杂质,所选试剂及操作都正确的是( )
| 物 质 | 杂 质 | 试 剂 | 操 作 | |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | - | 加热 |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | O2 | 水蒸气 | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
12.某化学兴趣小组在做完用石灰石和稀盐酸制取二氧化碳的实验后,对反应后的剩余溶液的溶质成分产生了兴趣,他们进行了以下实验探究.
【提出猜想】猜想一:只有CaCl2; 猜想二:CaCl2和HCl.
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案.
【评价反思】(1)方案1发生反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(2)有同学提出方案2是错误的,原因是氯化钙和稀盐酸都能够和硝酸银反应生成白色沉淀氯化银.
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是剩余的少量固体可能是不能和稀盐酸反应的杂质.
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
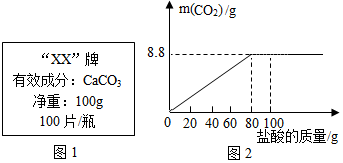
(1)该品牌补钙药剂中CaCO3的质量分数是50%,a的数值为25.
(2)求该盐酸中溶质的质量分数为多少?(写出计算过程,计算结果保留一位小数).
【提出猜想】猜想一:只有CaCl2; 猜想二:CaCl2和HCl.
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案.
| 方案编号 | 方案1 | 方案2 |
| 实验操作 (分别取少量实验后的溶液于试管中) | 加入少许氧化铁 | 滴加硝酸银溶液 |
| 实验现象 | 固体逐渐消失,溶液由无色变成黄色 | 产生白色沉淀. |
| 实验结论 | 猜想二成立. | |
(2)有同学提出方案2是错误的,原因是氯化钙和稀盐酸都能够和硝酸银反应生成白色沉淀氯化银.
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是剩余的少量固体可能是不能和稀盐酸反应的杂质.
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.

| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |
(2)求该盐酸中溶质的质量分数为多少?(写出计算过程,计算结果保留一位小数).
9.某学校的化学学习小组在实验时,用到了三个分别盛有Na2CO3溶液、NaOH溶液和NaCl溶液的试剂瓶,李铭发现王潇在取用溶液时,用一支滴管分别取用了三种溶液,且在取用时没有将滴管进行清洗,他认为王潇的操作不规范,这样会使试剂瓶中的溶液受污染而无法再次使用,于是学习小组就盛有NaCl溶液的试剂瓶是否被另外两种溶液污染了而进行如下探究:
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】
猜想Ⅰ:溶质成分只有:NaCl.
猜想Ⅱ:溶质成分为:NaCl和NaOH.
猜想Ⅲ:溶质成分为:NaCl和Na2CO3
猜想Ⅳ:溶质成分为:NaCl、NaOH和Na2CO3
【实验探究】为验证猜想,李铭设计了如下的实验方案,请你极爱你过实验步骤补充完整.
步骤(2)中发生的化学反应方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl.
【得出结论】猜想Ⅳ成立.
【实验反思】王潇认为凭借上述的实验步骤并不能排除猜想Ⅲ成立的可能性,因为碳酸钠的溶液碱性.
【实验改进】
找出问题后,该实验小组同学将实验步骤进行了调整,他们先进行了步骤(2),再进行步骤(1),为保证结论准确且实验现象便于观察,先加入的试剂应该足量(选填“足量”或“少量”),且两个步骤之间需要进行的实验操作是过滤,请写出该步骤需要用到的一种玻璃仪器玻璃棒.
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】
猜想Ⅰ:溶质成分只有:NaCl.
猜想Ⅱ:溶质成分为:NaCl和NaOH.
猜想Ⅲ:溶质成分为:NaCl和Na2CO3
猜想Ⅳ:溶质成分为:NaCl、NaOH和Na2CO3
【实验探究】为验证猜想,李铭设计了如下的实验方案,请你极爱你过实验步骤补充完整.
| 实验操作 | 实验结果 |
| (1)取少量试剂瓶内溶液于试管中,并加入过量酚酞试液. | 溶液呈红色 |
| (2)再向上述溶液中加入适量BaCl2溶液. | 有白色沉淀生成 |
【得出结论】猜想Ⅳ成立.
【实验反思】王潇认为凭借上述的实验步骤并不能排除猜想Ⅲ成立的可能性,因为碳酸钠的溶液碱性.
【实验改进】
找出问题后,该实验小组同学将实验步骤进行了调整,他们先进行了步骤(2),再进行步骤(1),为保证结论准确且实验现象便于观察,先加入的试剂应该足量(选填“足量”或“少量”),且两个步骤之间需要进行的实验操作是过滤,请写出该步骤需要用到的一种玻璃仪器玻璃棒.
10.下列对实验异常情况分析不合理的是( )
| A. | 测定空气中氧气的含量时,实验结果小于$\frac{1}{5}$--红磷过量 | |
| B. | 经过多次过滤的河水仍然浑浊--滤纸破损 | |
| C. | 点燃氢气时突然发生爆炸--点燃前没有检验纯度 | |
| D. | 制取CO2时始终没有收集到CO2--装置气密性不好 |

 化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)
化学兴趣小组的同学们用下列药品探究影响金属与酸反应速率的因素.装置中产生氢气的量可以用压强传感器测出(在等温条件下,产生氢气体积与装置内压强成正比.反应放热忽略不计)