题目内容
18.看图回答问题:
(1)氮原子核内质子数为7,最外层电子数为5,它与硼元素(元素符号为B)形成原子个数比为1:1的高温超导材料氮化硼的化学式为BN;
(2)Mg和Ca的化学性质都比较活泼(填“活泼”或“不活泼”);镁离子的符号为Mg2+;
(3)He的化学性质不活泼(填“活泼”或“不活泼”),由此可知,最外层电子数相同时,化学性质不一定(填“一定”或“不一定”)相似.
分析 (1)由氮的原子结构示意图,可知:核内质子数、核外电子数、最外层电子数等信息;
(2)分析元素的化学性质,根据原子结构示意图的结构特点,写出离子的符号;
(3)对比原子结构示意图,结合元素的化学性质,归纳最外层电子相同时,元素化学性质的相似性.
解答 解:由氮的原子结构示意图,可知:
(1)氮原子核内质子数为7,最外层电子数为5.它与硼元素(元素符号为B)形成原子个数比为1:1的高温超导材料氮化硼的化学式为BN.
故答为:7,5;BN;
(2)由金属活动性可得知,钙、镁都是比较活泼的金属;镁原子最外层有2个电子,表现出易失去最外层电子形成带2个单位正电荷的镁离子;
故答案为:活泼;Mg2+;
(3)氦为稀有气体元素,其化学性质不活泼;但氦原子的最外层电子数与镁、钙相同都是2个,因此,最外层电子数相同时,元素的化学性质不一定相似;
故答案为:不活泼;不一定
点评 质子数决定元素的种类,最外层电子数决定元素的化学性质.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
9.在CuSO4和FeSO4的混合溶液中加入锌粉,下面几种情况中不可能出现的是( )
| A. | 锌粉无剩余,溶液中若有Cu2+,则必定有Fe2+ | |
| B. | 锌粉有剩余,溶液中只有Fe2+,而无Zn2+和Cu2+ | |
| C. | 锌粉无剩余,溶液中无Cu2+,一定有Zn2+,可能有Fe2+ | |
| D. | 锌粉有剩余,溶液中只有Zn2+,而无Cu2+和Fe2+ |
13.1923年丹麦化学家布朗斯台特提出一种理论叫酸碱质子论,认为规定凡是能够释放质子(H+)的任何物质(包括分子或离子)都是酸,任何能接受质子的分子或离子都是碱,根据这一理论,下列各项即属于酸又属于碱的是( )
| A. | HNO3 | B. | OH- | C. | NH3 | D. | HS- |
10.化学是一门以实验为基础的自然科学,初中化学做过许多实验,例如:
若按科学探究的方法进行分类,应将C归为B(选填“A”或“B”)组,理由是通过模型来揭示原型的形态、特征和本质.
| A组 | B组 | C组 | |
水和空气压缩的实验 | 比较酒精灯内焰和外焰的温度 | 水是由水分子构成的 | 原子大小示意图 |
6.图1是某兴趣小组自制电解水的实验装置图,图2是他们分析水电解的微观示意图.下列所得结论中,正确的是
( )
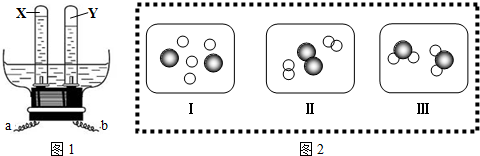
( )

| A. | 图1中,a电极是直流电源的负极 | |
| B. | 图1中X与Y的分子个数比为1:2,质量比为8:1 | |
| C. | 图2微观图示Ⅰ中,元素的化合价分别为+1和-2 | |
| D. | 若图2表示合成水的微观示意图,则反应过程顺序为Ⅱ→Ⅰ→Ⅲ |
7.下列说法中正确的是( )
| A. | 空气是人类的生命支柱,也是重要的自然资源,但不能作为工业原料 | |
| B. | 无色无味的气体是空气 | |
| C. | 空气由多种气体组成,大致是氮气占78%,氧气占21%(体积分数) | |
| D. | 空气是稳定的纯净物 |
 A、B、C、D、E、F均为初中化学中常见的物质,已知B是钠盐,它们之间存在如图的转化关系.“→”表示物质间存在着相应的转化关系,“-”表示物质间能发生反应(部分反应物、生成物和反应条件未标出).请问答下列问题:
A、B、C、D、E、F均为初中化学中常见的物质,已知B是钠盐,它们之间存在如图的转化关系.“→”表示物质间存在着相应的转化关系,“-”表示物质间能发生反应(部分反应物、生成物和反应条件未标出).请问答下列问题: