题目内容
13.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为常见的两种化合物,其中碳酸钠最为重要,在工业上有广泛的应用.在生活中,碳酸氢钠是常用的发酵剂的主要成分.Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3(填化学式)
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.某天然碱中可能含有碳酸钠和碳酸氢钠,小明同学设计了如下实验探究其组成.请分析其过程完成填空.
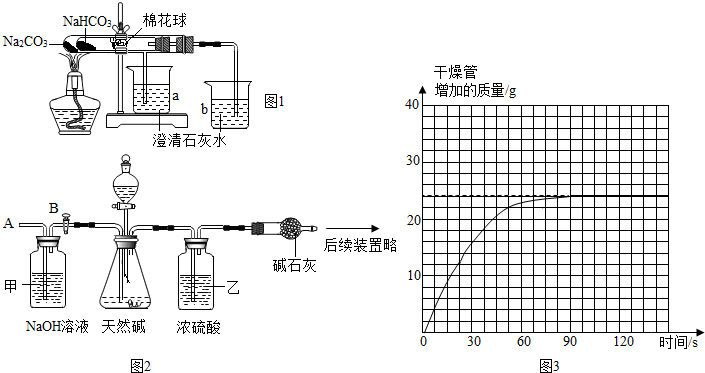
在老师的指导下采用了图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:①结论:碳酸氢钠(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质;②写出b烧杯中发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
同学们还查阅到如下资料:
(1)2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+H2O
(2)Ca(HCO3)2+Na2CO3=CaCO3↓+2NaHCO3
(3)CaCl2稀溶液与NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为碳酸氢钠和碳酸钠.
【实验方案】
方案一:取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:
可选药品:NaOH溶液 稀盐酸 Ca(OH)2溶液 CaCl2溶液
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取天然碱样品少量溶于足量水后,加入过量的CaCl2稀溶液(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
| 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的Ca(OH)2溶液,观察. | 无沉淀出现 | 假设二成立 |
| 产生白色沉淀 | 假设三成立 |
(1)按图组装仪器,将52.5g试样放入锥形瓶中,打开活塞B,从导管A处缓缓鼓入一定量的空气;
(2)准确称量干燥管的质量后再次连接好装置;
(3)关闭活塞B,打开分液漏斗的活塞和上面的塞子,加入足量某酸溶液;
(4)待锥形瓶中不再产生气泡时,打开活塞B,再次从导管A处缓缓鼓入一定量的空气,直至干燥管内物质质量不变;
(5)再次称量干燥管的质量;并绘制干燥管增加的质量与时间的关系图2、图3(见图);
讨论:
①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;装置乙的作用是吸收二氧化碳中混有的水蒸气.第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程)
分析 Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是碳酸;
(2)碳酸氢钠能和胃酸中的稀盐酸反应生成氯化钠、水和二氧化碳;
Ⅱ.碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;
【假设猜想】
天然碱成分可能是碳酸氢钠,也可能是碳酸钠,或碳酸氢钠和碳酸钠;
【实验方案】
如果澄清石灰水不能变浑浊,说明是碳酸钠,如果澄清石灰水变浑浊,说明是碳酸氢钠,或碳酸氢钠和碳酸钠;
为了防止实验装置漏气影响实验结果,应该检查装置的气密性;
稀硫酸不具有挥发性;
氢氧化钠溶液能够吸收二氧化碳;
浓硫酸具有吸水性,可以用来干燥二氧化碳气体;
根据提供的数据可以计算试样中碳酸氢钠的质量分数.
解答 解:Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3;
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑.
故填:H2CO3;NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.①结论:碳酸氢钠受热分解出水和CO2等物质;
②b烧杯中,二氧化碳和氢氧化钙反应生成碳酸钙和水,发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
故填:碳酸氢钠;CO2+Ca(OH)2═CaCO3↓+H2O.
【假设猜想】
天然碱成分可能是碳酸氢钠,也可能是碳酸钠,或碳酸氢钠和碳酸钠.
故填:碳酸氢钠和碳酸钠.
【实验方案】
方案一:这种方案不合理,理由是:如果澄清石灰水不能变浑浊,说明是碳酸钠,如果澄清石灰水变浑浊,说明是碳酸氢钠,或碳酸氢钠和碳酸钠,即只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
故填:否;只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:操作一:取天然碱样品少量溶于足量水后,加入过量的 CaCl2稀溶液,无沉淀出现,假设一成立;
操作二:待操作一中反应充分后过滤,并在滤液中加入过量的 Ca(OH)2溶液,如果不产生沉淀,说明假设二成立;
如果产生白色沉淀,说明假设三成立.
故填:CaCl2稀溶液;Ca(OH)2溶液;无沉淀出现;产生白色沉淀.
Ⅲ.①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
故填:检查装置的气密性;稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;
装置乙的作用是吸收二氧化碳中混有的水蒸气;
第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
故填:吸收空气中的二氧化碳;吸收二氧化碳中混有的水蒸气;使反应生成的二氧化碳全部被碱石灰吸收.
③设碳酸氢钠的质量为x,反应生成二氧化碳的质量为y,
由图中数据可知,反应生成二氧化碳的质量为22g,
NaHCO3+HCl═NaCl+H2O+CO2↑,Na2CO3+2HCl═2NaCl+H2O+CO2↑,
84 44 106 44
x y 52.5g-x 22g-y
$\frac{84}{44}$=$\frac{x}{y}$,$\frac{106}{44}$=$\frac{52.5g-x}{22g-y}$,
x=1.9g,
则碳酸氢钠的质量分数为:$\frac{1.9g}{52.5g}$×100%=3.6%,
答:试样中碳酸氢钠的质量分数是3.6%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 盐 | B. | 氧化物 | C. | 碱 | D. | 单质 |
 已知某混合液由HCl、K2CO3、H2SO4、CuCl2、NaCl溶液中的几种混合而成,向该混合液中加Ba(OH)2溶液,产生沉淀量与加的Ba(OH)2溶液体积关系如图.则下列说法正确的是( )
已知某混合液由HCl、K2CO3、H2SO4、CuCl2、NaCl溶液中的几种混合而成,向该混合液中加Ba(OH)2溶液,产生沉淀量与加的Ba(OH)2溶液体积关系如图.则下列说法正确的是( )| A. | 混合液一定是HCl和CuCl2混合而成 | B. | 混合液中一定没有K2CO3和H2SO4 | ||
| C. | F点溶液中的溶质肯定只有一种 | D. | 沉淀完全时,消耗Ba(OH)26.84g |
| A. | 蒸馏水 | B. | 碘酒 | C. | 牛奶 | D. | 石灰乳 |
【提出问题】滤液中的溶质可能有哪些?
【提出猜想】①只有Zn(NO3)2②Zn(NO3)2、AgNO3③Zn(NO3)2、Fe(NO3)2④Zn(NO3)2、AgNO3、Fe(NO3)2
【交流讨论】不合理的猜想是②(填标号),其理由是硝酸银能和铁反应生成硝酸亚铁和银;
【实验探究一】若猜想①成立,通过以下实验课确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 要少量固体B,滴加 稀盐酸 | 有气泡产生 | Zn+2HCl═ZnCl2+H2↑ |
(1)固体甲中含有的物质是(填化学式)Fe、Ag;溶液乙的化学式为Zn(NO3)2、Fe(NO3)2.
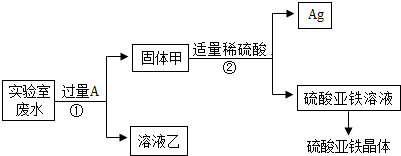
(2)写出步骤①的化学方程式:Fe+2AgNO3=Fe(NO3)2+2Ag.
【实验探究三】银、铁、铜是日常生活中经常接触到的三种金属,对Ag、Fe、Cu三种金属活动顺序的探究,下列所选试剂组不可行的是②.
①Fe、Ag、CuSO4溶液;②Cu、Ag、FeSO4溶液;③Cu、FeSO4溶液、AgNO3溶液
在你认为可行的试剂组中,写出其中发生反应的化学方程式Fe+CuSO4═FeSO4+Cu(若可行的试剂不只一组,请任选其中一组).




