题目内容
3.某兴趣小组将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其成分反应后过滤,得到滤液A和固体B,并对滤液的组成进行研究.【提出问题】滤液中的溶质可能有哪些?
【提出猜想】①只有Zn(NO3)2②Zn(NO3)2、AgNO3③Zn(NO3)2、Fe(NO3)2④Zn(NO3)2、AgNO3、Fe(NO3)2
【交流讨论】不合理的猜想是②(填标号),其理由是硝酸银能和铁反应生成硝酸亚铁和银;
【实验探究一】若猜想①成立,通过以下实验课确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 要少量固体B,滴加 稀盐酸 | 有气泡产生 | Zn+2HCl═ZnCl2+H2↑ |
(1)固体甲中含有的物质是(填化学式)Fe、Ag;溶液乙的化学式为Zn(NO3)2、Fe(NO3)2.
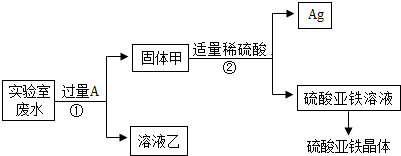
(2)写出步骤①的化学方程式:Fe+2AgNO3=Fe(NO3)2+2Ag.
【实验探究三】银、铁、铜是日常生活中经常接触到的三种金属,对Ag、Fe、Cu三种金属活动顺序的探究,下列所选试剂组不可行的是②.
①Fe、Ag、CuSO4溶液;②Cu、Ag、FeSO4溶液;③Cu、FeSO4溶液、AgNO3溶液
在你认为可行的试剂组中,写出其中发生反应的化学方程式Fe+CuSO4═FeSO4+Cu(若可行的试剂不只一组,请任选其中一组).
分析 【交流讨论】
锌和硝酸银反应生成硝酸锌和银,铁和硝酸银反应生成硝酸亚铁和银;
【实验探究一】
锌能和稀盐酸反应生成氯化锌和氢气;
【实验探究二】
因为需要得到硫酸亚铁晶体,因此加入的A应该是铁;
【实验探究三】
铜和银不如铁活泼,不能和硫酸亚铁反应;
①中,铁能和硫酸铜反应生成硫酸亚铁和铜,银不能和硫酸铜反应.
解答 解:【交流讨论】
不合理的猜想是②,其理由是:如果滤液中含有硝酸银,则铁和硝酸银反应生成硝酸亚铁和银,滤液中应该有硝酸亚铁.
故填:②;硝酸银能和铁反应生成硝酸亚铁和银.
【实验探究一】
若猜想①成立,则锌过量或恰好完全反应,如果过量时,锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑.
故填:稀盐酸;Zn+2HCl═ZnCl2+H2↑.
【实验探究二】
(1)固体甲中含有的物质有过量的铁和反应生成的银;
溶液乙中含有硝酸锌和硝酸亚铁.
故填:Fe、Ag;Zn(NO3)2、Fe(NO3)2.
(2)步骤①中,铁和硝酸银反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag.
故填:Fe+2AgNO3=Fe(NO3)2+2Ag.
【实验探究三】
对Ag、Fe、Cu三种金属活动顺序的探究,下列所选试剂组不可行的是②,因为铜、银都不能和硫酸亚铁反应,因此只能够确定铁比铜和银活泼,不能确定铜和银的活泼性顺序;
①组可行,铁能和硫酸铜反应,银不能和硫酸铜反应,因此铁比铜活泼,铜比银活泼,其中铁和硫酸铜发生反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:②;Fe+CuSO4═FeSO4+Cu.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
13.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为常见的两种化合物,其中碳酸钠最为重要,在工业上有广泛的应用.在生活中,碳酸氢钠是常用的发酵剂的主要成分.
Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3(填化学式)
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.某天然碱中可能含有碳酸钠和碳酸氢钠,小明同学设计了如下实验探究其组成.请分析其过程完成填空.
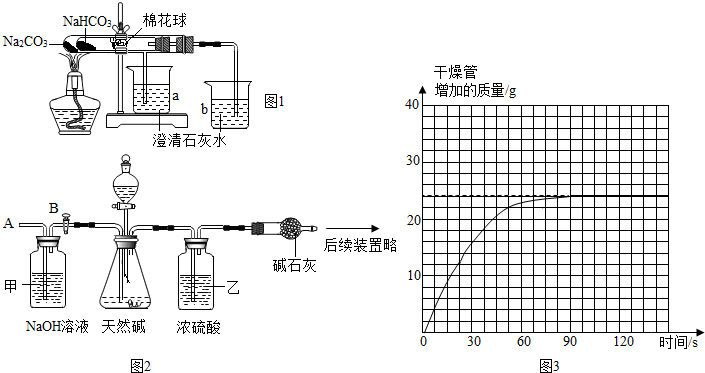
在老师的指导下采用了图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:①结论:碳酸氢钠(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质;②写出b烧杯中发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
同学们还查阅到如下资料:
(1)2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+H2O
(2)Ca(HCO3)2+Na2CO3=CaCO3↓+2NaHCO3
(3)CaCl2稀溶液与NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为碳酸氢钠和碳酸钠.
【实验方案】
方案一:取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:
可选药品:NaOH溶液 稀盐酸 Ca(OH)2溶液 CaCl2溶液
Ⅲ.为测定天然碱中的成分,小组的同学设计了如下实验,其主要实验步骤如下:
(1)按图组装仪器,将52.5g试样放入锥形瓶中,打开活塞B,从导管A处缓缓鼓入一定量的空气;
(2)准确称量干燥管的质量后再次连接好装置;
(3)关闭活塞B,打开分液漏斗的活塞和上面的塞子,加入足量某酸溶液;
(4)待锥形瓶中不再产生气泡时,打开活塞B,再次从导管A处缓缓鼓入一定量的空气,直至干燥管内物质质量不变;
(5)再次称量干燥管的质量;并绘制干燥管增加的质量与时间的关系图2、图3(见图);
讨论:
①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;装置乙的作用是吸收二氧化碳中混有的水蒸气.第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程)
Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3(填化学式)
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.某天然碱中可能含有碳酸钠和碳酸氢钠,小明同学设计了如下实验探究其组成.请分析其过程完成填空.

在老师的指导下采用了图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:①结论:碳酸氢钠(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质;②写出b烧杯中发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
同学们还查阅到如下资料:
(1)2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+H2O
(2)Ca(HCO3)2+Na2CO3=CaCO3↓+2NaHCO3
(3)CaCl2稀溶液与NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为碳酸氢钠和碳酸钠.
【实验方案】
方案一:取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:
可选药品:NaOH溶液 稀盐酸 Ca(OH)2溶液 CaCl2溶液
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取天然碱样品少量溶于足量水后,加入过量的CaCl2稀溶液(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
| 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的Ca(OH)2溶液,观察. | 无沉淀出现 | 假设二成立 |
| 产生白色沉淀 | 假设三成立 |
(1)按图组装仪器,将52.5g试样放入锥形瓶中,打开活塞B,从导管A处缓缓鼓入一定量的空气;
(2)准确称量干燥管的质量后再次连接好装置;
(3)关闭活塞B,打开分液漏斗的活塞和上面的塞子,加入足量某酸溶液;
(4)待锥形瓶中不再产生气泡时,打开活塞B,再次从导管A处缓缓鼓入一定量的空气,直至干燥管内物质质量不变;
(5)再次称量干燥管的质量;并绘制干燥管增加的质量与时间的关系图2、图3(见图);
讨论:
①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;装置乙的作用是吸收二氧化碳中混有的水蒸气.第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程)
18.下表列出了除去物质中所含少量杂质的方法,其中正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | H2 | 水蒸气 | 通过盛有氢氧化钠溶液的洗气瓶 |
| B | H2O | Mg(OH)2 | 过滤 |
| C | N2 | O2 | 通过炽热的木炭 |
| D | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
8.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和操作做错误的是( )
| A. | CaCO3(NaCl) 加水,将固体溶解后过滤 | |
| B. | Cu粉(Fe粉) 加过量稀盐酸,充分反应后过滤 | |
| C. | KCI溶液(CuCl2) 加适量KOH溶液过滤 | |
| D. | CO2气体(SO2) 将气体通入盛有NaOH溶液的洗气瓶 |
12.2015年“世界水日”和“中国水周”活动的宣传主题为“节约水资源,保障水安全”. 下列关于水的认识不正确的( )
| A. | 水中Ca2+、Mg2+的增多会引起水体富营养化 | |
| B. | 电解水实验可证明水是由氢、氧两种元素组成 | |
| C. | 生活中可以用煮沸的方法能降低水的硬度 | |
| D. | 水经过“三态”变化实现在自然界中的循环 |
