题目内容
7.现有21.2g碳和氧化铜组成的黑色固体混合物,放入试管中高温加热,使其充分反应后,把生成的气体全部通入足量的澄清石灰水中,结果生成10.0g白色沉淀.求黑色固体混合物中各物质的质量分数(结果保留到0.1%)【已知 C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,CO2+Ca(OH)2=CaCO3↓+H2O】
分析 碳和氧化铜反应生成铜和二氧化碳;由题意,把生成的气体全部通入足量的澄清石灰水中,结果生成10.0g白色沉淀,由反应的化学方程式列式计算出混合固体中碳的质量,进而可计算出黑色固体混合物中各物质的质量分数.
解答 解:由C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,CO2+Ca(OH)2=CaCO3↓+H2O,
则C~CO2~CaCO3,
即C~CaCO3,设参加反应的碳的质量为x,
12 100
x 10g
$\frac{12}{100}=\frac{x}{10g}$ x=1.2g
黑色固体混合物中碳的质量分数为$\frac{1.2g}{21.2g}$×100%≈5.7%.
黑色固体混合物中氧化铜的质量分数为1-5.7%=94.3%.
答:黑色固体混合物中碳的质量分数为5.7%;黑色固体混合物中氧化铜的质量分数为94.3%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
18.一定质量的某物质完全燃烧后生成3.6gH2O和4.4gCO2,则该物质可能是( )
| A. | CH4 | B. | CH3OH | C. | CH3CH2OH | D. | CH3COOH |
5.下列做法不符合“低碳”环保的是( )
| A. | 古运河沿线建百米绿化带,打造扬州“外滩” | |
| B. | 关闭重污染化工厂 | |
| C. | 电器不用时将插头拔掉 | |
| D. | 将秸秆堆积起来进行焚烧 |
12.从分子的角度分析并解释下列事实,说法不正确的是( )
| 事实 | 解释 | |
| A | 碘酒是混合物 | 由不同分子构成 |
| B | 八月桂花香 | 分子在不停运动 |
| C | 气体受热膨胀 | 温度升高,分子自身体积增大 |
| D | 碘受热升华 | 分子间间隔增大 |
| A. | A | B. | B | C. | C | D. | D |
9.在一个密闭的容器中放有6g炭粉和充有10g氧气,用电火花引燃,使两者进行充分的反应,则反应后容器内的气体是( )
| A. | CO | B. | CO2 | C. | CO与CO2 | D. | O2 与 CO2 |
10.下列物质中,属于纯净物的是( )
| A. |  黄酒 | B. |  矿泉水 | C. |  24K黄金 | D. |  铁矿石 |
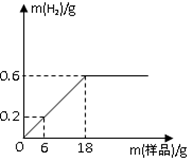 B为测定某钢材中碳的含量(假设该钢材样品中的杂质只有碳,不溶于水也不与盐酸反应),往盛有盐酸的烧杯中不断加入钢材佯品,测得生成氢气质量与所加钢材样品质量的关系如图所示
B为测定某钢材中碳的含量(假设该钢材样品中的杂质只有碳,不溶于水也不与盐酸反应),往盛有盐酸的烧杯中不断加入钢材佯品,测得生成氢气质量与所加钢材样品质量的关系如图所示