题目内容
19.某食盐样品中含有少量沙土、氯化钙和氯化镁.如图是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
根据流程图回答:
(1)写出NaOH与杂质反应的化学方程式2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(2)加入试剂B的目的是除去过量的氢氧化钠和碳酸钠.
分析 (1)根据氢氧化钠与氯化镁的反应写出反应的化学方程式;
(2)根据过量试剂会成为新的杂质,也要除去分析回答.
解答 解:(1)由实验的流程图可知,加入的氢氧化钠与氯化镁发生了反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(2)由实验流程可知,在实验过程中为了除去氯化镁加入了过量的氢氧化钠,为了除去氯化钙,加入过量的试剂A应是碳酸钠,为了不引入新的杂质,应加入试剂B是盐酸,加入试剂B目的是:除去过量的氢氧化钠和碳酸钠.
故答案为:(1)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;(2)除去过量的氢氧化钠和碳酸钠.
点评 除杂质时加入的试剂只能与杂质反应,不能引入新的杂质,将不溶于液体的固体和液体分离用过滤的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列是有关实验操作的步骤和做法,正确的是( )
| A. | 粗盐提纯操作的顺序是:溶解、过滤、蒸发、洗涤 | |
| B. | 实验室制取氧气完毕后,应先停止加热,再取出导管 | |
| C. | 不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净 | |
| D. | 用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
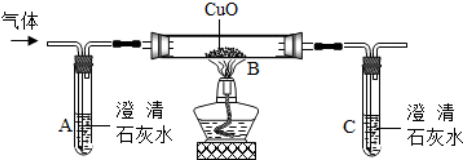
7.实验室制取二氧化碳,结合下列实验装置回答有关问题:
Ⅰ.实验室制取二氧化碳气体常用的药品是稀盐酸、大理石(填名称),该反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O;若将产生的二氧化碳导入澄清石灰水中,会观察到的现象是澄清石灰水变浑浊,发生反应的方程式是Ca(OH)2+C02=CaCO3↓+H20.
Ⅱ.如图中能控制反应发生和停止的装置是C(填字母).
②制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出, 杂质不溶于水且不参加反应):
杂质不溶于水且不参加反应):
Ⅰ.甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论.
查找资料:氯化钙溶液呈中性
Ⅱ.请写出乙同学实验过程中发生反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O.

Ⅰ.实验室制取二氧化碳气体常用的药品是稀盐酸、大理石(填名称),该反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O;若将产生的二氧化碳导入澄清石灰水中,会观察到的现象是澄清石灰水变浑浊,发生反应的方程式是Ca(OH)2+C02=CaCO3↓+H20.
Ⅱ.如图中能控制反应发生和停止的装置是C(填字母).
②制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出,
 杂质不溶于水且不参加反应):
杂质不溶于水且不参加反应):Ⅰ.甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论.
查找资料:氯化钙溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加紫色石蕊试液 | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液至过量 | 有气泡冒出 |
 能源和环境成为人们日益关注的问题.目前煤炭在我国能源结构中占有的比例最大.
能源和环境成为人们日益关注的问题.目前煤炭在我国能源结构中占有的比例最大.
 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题: