题目内容
20.除去下列各物质中的少量杂质,可以达到目的是( )| 编号 | 物质 | 杂质 | 除杂操作方法 |
| A | CO2 | CO | 点燃 |
| B | NaOH | NaCl | 加足量盐酸 |
| C | 氯化钠 | 泥沙 | 加足量的水,溶解、蒸发、结晶 |
| D | O2 | 水蒸气 | 用浓硫酸洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
B、NaOH能与足量盐酸反应生成氯化钠和水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发、结晶的方法进行分离除杂,故选项所采取的方法正确.
D、浓硫酸具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:CD.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
19.下列说法中,正确的是( )
| A. | 浓盐酸、浓硫酸都易挥发 | B. | CH4、C2H5OH都能作燃料 | ||
| C. | Al(OH)3、NaOH都能治疗胃酸过多症 | D. | CO2、SO2都是有毒气体 |
5. 嫩肉粉又称嫩肉晶,其主要作用在于利用蛋白酶对肉中的弹性蛋白和胶原蛋白进行部分水解,使肉类制品口感达到不韧、味美鲜香的效果.安多夫是一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3).小于发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行研究.
嫩肉粉又称嫩肉晶,其主要作用在于利用蛋白酶对肉中的弹性蛋白和胶原蛋白进行部分水解,使肉类制品口感达到不韧、味美鲜香的效果.安多夫是一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3).小于发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行研究.
【查阅资料】
无水硫酸铜是白色粉末,遇水由白色变蓝色,生成五水硫酸铜(CuSO4•5H2O).
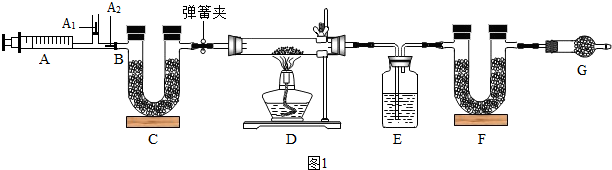
(1)小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2.他设法收集气体样品并除去醋酸气体后,用如图实验装置进行验证.装置a中盛放的试剂是无水硫酸铜.
(2)小于对二氧化碳的来源作了两种猜测:
猜测①:可能是醋酸与碳酸氢钠反应生成的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小于分别设计了以下实验:
实验结论:猜想①、②都正确
(3)实验2中,小于发现充分反应后,试管中仍留有一些白色粉末,他猜测可能是氢氧化钠或碳酸钠,请用物理、化学方法各1种进行鉴别.
①物理方法:各取少量固体溶于水放热的是氢氧化钠;
②化学方法:加入氯化钙有沉淀产生的是碳酸钠.
 嫩肉粉又称嫩肉晶,其主要作用在于利用蛋白酶对肉中的弹性蛋白和胶原蛋白进行部分水解,使肉类制品口感达到不韧、味美鲜香的效果.安多夫是一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3).小于发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行研究.
嫩肉粉又称嫩肉晶,其主要作用在于利用蛋白酶对肉中的弹性蛋白和胶原蛋白进行部分水解,使肉类制品口感达到不韧、味美鲜香的效果.安多夫是一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3).小于发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行研究.【查阅资料】
无水硫酸铜是白色粉末,遇水由白色变蓝色,生成五水硫酸铜(CuSO4•5H2O).
(1)小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2.他设法收集气体样品并除去醋酸气体后,用如图实验装置进行验证.装置a中盛放的试剂是无水硫酸铜.
(2)小于对二氧化碳的来源作了两种猜测:
猜测①:可能是醋酸与碳酸氢钠反应生成的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的.
针对以上猜测,小于分别设计了以下实验:
| 实验步骤 | 实验现象 | |
| 实验1 | 取碳酸氢钠样品少许加入试管中,加入少量醋酸使之充分反应,并把生的气体通入澄清石灰水 | 有气泡产生,石灰水变浑浊 |
| 实验2 | 取碳酸氢钠样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊. |
(3)实验2中,小于发现充分反应后,试管中仍留有一些白色粉末,他猜测可能是氢氧化钠或碳酸钠,请用物理、化学方法各1种进行鉴别.
①物理方法:各取少量固体溶于水放热的是氢氧化钠;
②化学方法:加入氯化钙有沉淀产生的是碳酸钠.
12.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前后各物质质量如表:
反应中乙、丁的质量变化之比为7:5;该化学反应的基本类型化合反应.
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 16 | 4 | 2 | 24 |
| 反应后质量/g | 8 | 32 | 2 | x |
9.取部分锈蚀的铁片样品(仅由铁和氧化铁组成)13.6g,通入足量的一氧化碳并灼热至完全反应,将所得固体加入到150g稀盐酸中,恰好完全反应,得到溶液160.8g.则原金属铁中被氧化的铁的质量分数为( )
| A. | 42% | B. | 50% | C. | 63% | D. | 66.7% |
10.不锈钢、氧化铁、硫酸铁三种物质的分类正确的是( )
| A. | 盐、氧化物、纯净物 | B. | 单质、混合物、盐 | ||
| C. | 混合物、氧化物、盐 | D. | 混合物、盐、化合物 |