题目内容
18. 1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑试回答下列问题:
1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑试回答下列问题:(1)在反应②的四种物质中,属于氧化物的是H2O、CO2.
(2)氨盐水比食盐水更容易吸收二氧化碳的原因是氨盐水显碱性,更容易吸收二氧化碳.
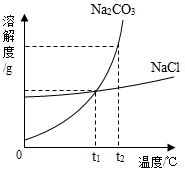
(3)氯化钠和碳酸钠的溶解度曲线如图,t2℃时,氯化钠
饱和溶液溶质的质量分数小于碳酸钠饱和溶液溶质的质量分数(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:氯化钠的溶解度受温度的影响不大,碳酸钠的溶解度受温度的影响较大,温度越高溶解度越大,夏天温度升高,水分蒸发,所以碳酸钠不易析出而氯化钠容易析出;冬天温度降低,碳酸钠溶解度减小,所以从溶液中析出.
分析 (1)氧化物是由氧元素和另外一种元素组成的化合物;
(2)氨盐水显碱性,容易和二氧化碳反应;
(3)饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
(4)根据物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)在反应②的四种物质中,水和二氧化碳都是由氧元素和另外一种元素组成的化合物,都属于氧化物.
故填:H2O、CO2.
(2)氨盐水比食盐水更容易吸收二氧化碳的原因是氨盐水显碱性,更容易吸收二氧化碳.
故填:氨盐水显碱性,更容易吸收二氧化碳.
(3)t2℃时,氯化钠的溶解度小于碳酸钠的溶解度,因此氯化钠饱和溶液溶质的质量分数小于碳酸钠饱和溶液溶质的质量分数.
故填:小于.
(4)“夏天晒盐,冬天捞碱”这句谚语的原理是:氯化钠的溶解度受温度的影响不大,碳酸钠的溶解度受温度的影响较大,温度越高溶解度越大,夏天温度升高,水分蒸发,所以碳酸钠不易析出而氯化钠容易析出;冬天温度降低,碳酸钠溶解度减小,所以从溶液中析出.
故填:氯化钠的溶解度受温度的影响不大,碳酸钠的溶解度受温度的影响较大,温度越高溶解度越大,夏天温度升高,水分蒸发,所以碳酸钠不易析出而氯化钠容易析出;冬天温度降低,碳酸钠溶解度减小,所以从溶液中析出.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
9.下列对实验现象的分析合理的是( )
| A. | 向某无色溶液中滴入酚酞试液,呈红色,证明该溶液是碱溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液,产生白色沉淀,证明该溶液是盐酸 | |
| C. | 某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝色的气体,证明该固体是铵盐 | |
| D. | 把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,则该气体是二氧化碳 |
13. 根据表中信息,请回答下列问题:
根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“徽”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇到水就分解了.
(1)CaCO3属于不溶物(填“可溶物”、”徽溶物”或“不溶物”).
(2)表中可溶于水的硫酸盐有3种.
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应.若能,写出化学方程式;若不能,说明理由.2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲.
①溶液甲中溶质的组成情况可能有3种.
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
b.探究溶液甲中是否含Ba(OH)2
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由:3,溶液中含有BaCl2,不论是否含有Ba(OH)2均会产生白色沉淀.
③欲从溶液甲中获得纯净的BaCl2固体,应采取的简单操作是测溶液甲的pH,若pH≤7,蒸发结晶;若pH>7,向溶液甲中加入盐酸至溶液pH≤7,再蒸发结晶.
 根据表中信息,请回答下列问题:
根据表中信息,请回答下列问题:部分碱、酸、盐的溶解性表(20℃)
| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- | PO43- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | 溶 | |
| K+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | 不 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | - | 不 |
(1)CaCO3属于不溶物(填“可溶物”、”徽溶物”或“不溶物”).
(2)表中可溶于水的硫酸盐有3种.
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应.若能,写出化学方程式;若不能,说明理由.2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲.
①溶液甲中溶质的组成情况可能有3种.
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
| 方案编号 | 实验操作 | 实验现象 |
| 1 | 取少量溶液甲于试管中,加入铁粉 | 是否有气泡产生 |
| 方案编号 | 实验操作 | 实验现象 |
| 2 | 取少量溶液甲于试管中,加入Cu(NO3)2溶液 | 是否产生蓝色沉淀 |
| 3 | 取少量溶液甲于试管中,加入Na2SO4溶液 | 是否产生白色沉淀 |
③欲从溶液甲中获得纯净的BaCl2固体,应采取的简单操作是测溶液甲的pH,若pH≤7,蒸发结晶;若pH>7,向溶液甲中加入盐酸至溶液pH≤7,再蒸发结晶.
3.下列各组离子能在pH=1的水溶液中大量共存且形成无色溶液的是( )
| A. | Ag+、Cl-、Fe2+、NO3- | B. | CO32-、K+、Na+、Cl- | ||
| C. | Cu2+、OH-、SO42-、Ba2+ | D. | NH4+、NO3-、Na+、Cl- |
10.在植物生长过程中,常需要施肥,种植甘蔗时(甘蔗主要食用茎),应多施用的化肥是( )
| A. | 微量元素肥料 | B. | KCl | C. | NH4NO3 | D. | Ca(H2PO4)2 |
7.下列实验设计能够成功的是( )
| 实验目的 | 实验操作 | |
| A | 实验室制备二氧化碳 | 将石灰石和稀硫酸混合 |
| B | 除去硫酸钠溶液中少量氯化钠杂质 | 向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
| C | 除去氯化钠固体中的少量碳酸钠 | 加入过量的稀盐酸,充分反应后,蒸发 |
| D | 除去二氧化碳中的少量的一氧化碳 | 将气体点燃 |
| A. | A | B. | B | C. | C | D. | D |
8.下列变化中,属于物理变化的是( )
| A. |  | B. |  | C. |  | D. |  |
