题目内容
20.在实际生产中,研究物质的溶解度有很重要的意义.下表是某些物质在不同温度下的溶解度,请根据表中数据回答下列问题.| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(2)NaCl和KNO3的溶解度随温度变化趋势的不同点是氯化钠溶解度随温度变化不大,硝酸钾溶解度随温度变化较大.
(3)40℃时,将质量均为20g的NaCl和KNO3分别溶解在盛有50g水的烧杯中,充分搅拌,下列有关所得溶液的说法正确的是abd(填字母序号).
a.得到的NaCl溶液是饱和溶液
b.两溶液溶质的质量分数KNO3大于NaCl
c.将两溶液升温至60℃时,此时两种溶液均达到饱和状态
d.将两溶液降温至20℃时,烧杯中剩余固体的质量KNO3大于NaCl.
分析 (1)根据氯化钠的溶解度受温度的影响变化不大进行解答;
(2)根据图表所给数据分析NaCl、KNO3的溶解度随温度变化情况;
(3)根据40℃时,NaCl和KNO3的溶解度以及受温度的影响情况来分析.
解答 解:(1)氯化钠的溶解度受温度的影响变化不大,所以从海水中获取粗盐采取的方法是蒸发溶剂;故填:蒸发溶剂;
(2)由图表中的数据可知,氯化钠溶解度随温度变化不大,硝酸钾溶解度随温度变化较大;故填:氯化钠溶解度随温度变化不大,硝酸钾溶解度随温度变化较大;
(3)40℃时,氯化钠的溶解度为36.6g,那么在该温度下的50g水中,最多能溶解18.3g氯化钠就达到饱和状态;
40℃时,硝酸钾的溶解度为63.9g,那么在该温度下的50g水中,最多溶解31.95g硝酸钾达到饱和状态.
若40℃时,将质量均为20g的NaCl和KNO3分别溶解在盛有50g水的烧杯中,充分搅拌,
a.氯化钠溶液是饱和的,硝酸钾溶液是不饱和的;
b.因为在50g水中,溶解的硝酸钾的是20g,溶解的氯化钠是18.3g,所以两溶液溶质的质量分数KNO3大于NaCl;
c.在40℃时,硝酸钾溶液没有饱和,升温后硝酸钾的溶液变大,仍为不饱和状态;
d.因为硝酸钾的溶解度受温度影响比较大,而氯化钠的溶解度受温度影响比较小,所以硝酸钾结晶析出的比较多.
故填:abd.
点评 本题难度不大,主要考查了根据固体的溶解度与温度的关系解决相关的问题,从而培养学生对知识的理解和应用.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
10. 为了保护公民身心健康,北京市出台严厉戒烟措施,凡是在公共场合抽烟着将被罚款500元,是因为香烟中含有一种叫钋的致命放射性元素,会毁坏人体的DNA.钋在元素周期表中的部分信息如图所示,下列描述不正确的是( )
为了保护公民身心健康,北京市出台严厉戒烟措施,凡是在公共场合抽烟着将被罚款500元,是因为香烟中含有一种叫钋的致命放射性元素,会毁坏人体的DNA.钋在元素周期表中的部分信息如图所示,下列描述不正确的是( )
 为了保护公民身心健康,北京市出台严厉戒烟措施,凡是在公共场合抽烟着将被罚款500元,是因为香烟中含有一种叫钋的致命放射性元素,会毁坏人体的DNA.钋在元素周期表中的部分信息如图所示,下列描述不正确的是( )
为了保护公民身心健康,北京市出台严厉戒烟措施,凡是在公共场合抽烟着将被罚款500元,是因为香烟中含有一种叫钋的致命放射性元素,会毁坏人体的DNA.钋在元素周期表中的部分信息如图所示,下列描述不正确的是( )| A. | 该元素的原子序数为84 | B. | 该元素属于非金属元素 | ||
| C. | 该元素原子的中子数为125 | D. | 该元素相对原子质量为209.0 |
11.金属材料与人类的生产和生活密切相关.
(1)在如图所示的金属制品中,利用金属导热性的是AC(填序号).
(2)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限.

图中信息可以说明:人类获得铜、铁和铝单质的先后顺序与金属活动性密切相关.金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测铬能否与硫酸铜溶液反应,理由是能,铬排在氢前,而铜排在氢后,铬的活动性大于铜.
(1)在如图所示的金属制品中,利用金属导热性的是AC(填序号).
 |  |  |
| A.蒸锅 | B.铜导线 | C.铁制暖气片 |

图中信息可以说明:人类获得铜、铁和铝单质的先后顺序与金属活动性密切相关.金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测铬能否与硫酸铜溶液反应,理由是能,铬排在氢前,而铜排在氢后,铬的活动性大于铜.
8.潜水员在水下呼吸用的气体是人造空气,它是由氦气和下列气体中的某种气体按一定比例混合而成的,这种气体为( )
| A. | O2 | B. | H2 | C. | CO2 | D. | CH4 |
15.用分子观点解释下列现象正确的是( )
| A. | 湿衣服晾晒变干是因为分子发生了变化 | |
| B. | 点燃乙醇是因为分子间隔变大了 | |
| C. | 瘪的乒乓球受热鼓起是因为分子变大了 | |
| D. | “酒香不怕巷子深”是因为分子不断运动 |
12.为研究影响铁锈蚀的因素,某同学做了如下探究实验.有关该实验说法正确的是( )
| 序号 | 内容 | 实验现象 |
| ① | 常温下将铁丝放在干燥的空气中一个月 | 铁丝表面依然光亮 |
| ② | 常温下将铁丝放在潮湿的空气中一小时 | 铁丝表面依然光亮 |
| ③ | 常温下将铁丝放在潮湿的氧气中一小时 | 铁丝表面略显灰暗 |
| ④ | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| ⑤ | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| A. | 对比①和②说明铁丝生锈需要水份 | |
| B. | 对比②③说明铁丝生锈与氧气浓度有关 | |
| C. | 对比③④说明铁丝生锈需要有氧气 | |
| D. | 对比④⑤说明铁丝生锈的速率与温度有关 |
10.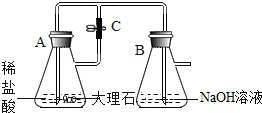 某化学实验小组的同学利用如图所示装置进行实验.A中反应开始时,弹簧夹C处于打开状态,一段时间后,关闭C,装置A中仍在反应.过一会儿,观察到装置B中出现白色沉淀,该沉淀的化学式为CaCO3.小组同学探究反应后装置B中的溶液的溶质成分.
某化学实验小组的同学利用如图所示装置进行实验.A中反应开始时,弹簧夹C处于打开状态,一段时间后,关闭C,装置A中仍在反应.过一会儿,观察到装置B中出现白色沉淀,该沉淀的化学式为CaCO3.小组同学探究反应后装置B中的溶液的溶质成分.
【提出问题】反应后装置B溶液的溶质成分是什么?
【猜想与假设】猜想1:NaCl、HCl;
猜想2:NaCl、CaCl2;
猜想3:NaCl、NaOH;
猜想4:NaCl、NaOH、Na2CO3.
【交流讨论】经讨论,大家一致认为猜想1一定不合理.理由是装置B出现的沉淀为CaCO3,会与盐酸反应.
【实验探究】将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想2不正确.
实验2:(填写下表)
【反思评价】实验结束后,同学们经过交流与讨论后认为:
探究反应后所得溶液的溶质成分时,不仅要考虑生成物还要考虑反应物是否过量.
 某化学实验小组的同学利用如图所示装置进行实验.A中反应开始时,弹簧夹C处于打开状态,一段时间后,关闭C,装置A中仍在反应.过一会儿,观察到装置B中出现白色沉淀,该沉淀的化学式为CaCO3.小组同学探究反应后装置B中的溶液的溶质成分.
某化学实验小组的同学利用如图所示装置进行实验.A中反应开始时,弹簧夹C处于打开状态,一段时间后,关闭C,装置A中仍在反应.过一会儿,观察到装置B中出现白色沉淀,该沉淀的化学式为CaCO3.小组同学探究反应后装置B中的溶液的溶质成分.【提出问题】反应后装置B溶液的溶质成分是什么?
【猜想与假设】猜想1:NaCl、HCl;
猜想2:NaCl、CaCl2;
猜想3:NaCl、NaOH;
猜想4:NaCl、NaOH、Na2CO3.
【交流讨论】经讨论,大家一致认为猜想1一定不合理.理由是装置B出现的沉淀为CaCO3,会与盐酸反应.
【实验探究】将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想2不正确.
实验2:(填写下表)
| 实验操作 | 先向滤液中加入过量Ba(NO3)2溶液 | 然后再向滤液中滴加酚酞溶液 |
| 实验现象 | 出现白色沉淀 | 溶液变红 |
| 实验结论 | 猜想4正确 | |
探究反应后所得溶液的溶质成分时,不仅要考虑生成物还要考虑反应物是否过量.
