题目内容
4.某补钙品(有效成分为碳酸钙,其他成分不含钙元素)的说明中标明含钙量为30%.李琳同学为了检验该产品,取10g该补钙品放入100g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其他成分不与盐酸反应).反应后剩余固体和液体的总质量比反应前减少了2.2g.试计算:(1)该补钙品中实际含钙的质量分数与说明中的标明含量是否相符?
(2)所用稀盐酸中溶质的质量分数是多少?
分析 分析反应的过程可知,反应生成唯一气体二氧化碳的放出造成反应后剩余固体和液体的总质量比反应前减少了2.2g,则可判断放出二氧化碳气体的质量为2.2g;利用反应的化学方程式,由二氧化碳的质量完成刚好完全反应时参加反应的碳酸钙和HCl质量的计算;然后由碳酸钙中钙元素的质量与补钙品质量比计算补钙品中实际含钙的质量分数、由溶液中溶质质量分数计算公式计算出所用稀盐酸中溶质的质量分数.
解答 解:(1)设补钙品中碳酸钙的质量为x,稀盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$
x=5g
$\frac{73}{y}=\frac{44}{2.2g}$
y=3.65g
CaCO3中钙元素的质量分数=$\frac{40}{100}$×100%=40%
补钙品中钙元素的实际含量=$\frac{5g×40%}{10g}$×100%=20%,
20%<30%,∴该补钙品实际含钙量与说明中的标明含量不相符;
(2)所用盐酸的溶质质量分数=$\frac{3.65g}{100g}$×100%=3.65%;
故答案为
(1)该补钙品实际含钙量与说明中的标明含量不相符
(2)3.65%
点评 根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
相关题目
6.常温下,下列各组物质中,乙既能与甲反应又能与丙反应的是( )
| 选项 | 物质甲 | 物质乙 | 物质丙 |
| A | HCl | Zn | AgCl |
| B | H2SO4 | Fe2O3 | NaCl |
| C | Ba(OH)2 | Na2CO3 | CaCl2 |
| D | H2SO4 | Ba(OH)2 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
4.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙.下列说法正确的是( )


| A. | 图丙中M表示b的溶解度曲线 | B. | 图甲溶液中溶质的质量分数a大于b | ||
| C. | 图乙中a、b溶液一定是不饱和溶液 | D. | 30℃时a、b溶液溶质质量分数不相等 |
11.实验室常用图1装置制取气体,请你根据所学知识回答下列问题.
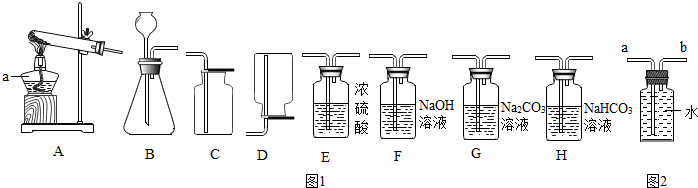
(1)仪器a的名称是酒精灯.
(2)实验室制取氧气时,选用的收集装置是C(填字母序号).若改用图2装置收集氧气,则气体应从b进(填“a”或“b”).
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).

(1)仪器a的名称是酒精灯.
(2)实验室制取氧气时,选用的收集装置是C(填字母序号).若改用图2装置收集氧气,则气体应从b进(填“a”或“b”).
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 气体中有HCl |
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).
9.KCl在不同温度下溶解度的数据如下表:
(1)60℃时,100g水中最多可溶解KCl45.5g.
(2)90℃时,100g饱和KCl溶液冷却到30℃时,溶液的质量(选填“>”或“<”或“=”)<100g.
(3)40℃时,KCl饱和溶液中溶质质量分数为28.6%;该溶液升温到60℃时,溶液属于不饱和溶液(选填“饱和”或“不饱和”).
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 | 56.7 |
(2)90℃时,100g饱和KCl溶液冷却到30℃时,溶液的质量(选填“>”或“<”或“=”)<100g.
(3)40℃时,KCl饱和溶液中溶质质量分数为28.6%;该溶液升温到60℃时,溶液属于不饱和溶液(选填“饱和”或“不饱和”).
13.下列有关铁的说法错误的是( )
| A. | 参考如图信息 ,铁的相对原子质量为26 ,铁的相对原子质量为26 | |
| B. | 生铁和钢是常见的铁合金 | |
| C. | 铁钉在潮湿的空气中容易生锈,因此钢铁的使用要注意防锈 | |
| D. | 用赤铁矿高炉炼铁的化学反应方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |