题目内容
11.现有40克10%的氯化钠溶液,欲使其质量分数增大一倍,下列方法可行的是( )①蒸发18克水;②蒸发20克水;③再加入5克溶质;④再加入4克溶质.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ①③ |
分析 要改变溶质的质量分数,有两个途径:①改变溶质的质量;②改变溶剂的质量.
解答 解:将40克10%的氯化钠溶液的质量分数增大一倍后的质量分数是20%.
①设要蒸发水的质量为x,根据溶液稀释前后,溶质的质量不变,
则40g×10%=(40g-x)×20%,x=20g.
②设需要再溶解氯化钠的质量为y,(40g+y)×20%=40g×10%+y,y=5g;
故选B.
点评 本题难度不是很大,考查溶液的浓缩问题,掌握溶液浓缩的方法、原理是正确解答此类题的关键所在.

练习册系列答案
相关题目
1.现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性.
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中,再加入等量的同种稀盐酸,操作与现象如表:
【思考结论】
(1)通过上述实验,判断出两种金属的活动性是A<B(填“>”或“<”).
(2)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeSO4(填化学式).
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中,再加入等量的同种稀盐酸,操作与现象如表:
| 实验 | 试管1 | 试管2 |
| 操作 | 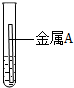 | 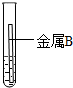 |
| 现象 | 金属表面产生气泡较慢 | 金属表面产生气泡较快 |
(1)通过上述实验,判断出两种金属的活动性是A<B(填“>”或“<”).
(2)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeSO4(填化学式).
2.对于天宫一号目标飞行器内镍氢电池的总反应式H2+2NiO(OH)=2Ni(OH)2,下列叙述不正确的是( )
| A. | H2是单质 | |
| B. | Ni(OH)2中Ni化合价为+2价 | |
| C. | NiO(OH)是氧化物 | |
| D. | 参加反应的H2、NiO(OH)的质量比为1:92 |
16.下表表示一杯刚配制的饱和硝酸钾溶液和硝酸钾在不同温度时的溶解度,要增加该溶液的溶质质量分数,下列操作正确的是( )
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 138 | 169 |
| A. | 升温 | B. | 降温 | C. | 加糖 | D. | 搅拌 |
3.用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数.实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴人几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量.数据如下表:
(1)本次实验中,实际消耗的氢氧化钠溶液质量为25克;
(2)请通过计算确定该瓶稀盐酸的溶质质量分数.
(3)另有同学做了同样的实验,却得到了不同的结果.于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数偏大(选填“偏大”或“偏小”),造成这一偏差的原因是滴加的氢氧化钠溶液过量.
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴人几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量.数据如下表:
| 锥形瓶 | 锥形瓶+稀盐酸 | 锥形瓶+反应后溶液 | |
| 质量(克) | 35.5 | 55.5 | 80.5 |
(2)请通过计算确定该瓶稀盐酸的溶质质量分数.
(3)另有同学做了同样的实验,却得到了不同的结果.于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数偏大(选填“偏大”或“偏小”),造成这一偏差的原因是滴加的氢氧化钠溶液过量.
1.有关饱和溶液的说法正确是( )
| A. | 一定是浓溶液 | B. | 降温后一定还是饱和溶液 | ||
| C. | 不能再溶解其它任何物质 | D. | 析出晶体后仍为饱和溶液 |
 如图是电解水的实验装置,通电后,两电极上都有气体放出,试管A得到的气体是:氢气,试管B得到的气体是:氧气,A与B两者的体积比约为:2:1.
如图是电解水的实验装置,通电后,两电极上都有气体放出,试管A得到的气体是:氢气,试管B得到的气体是:氧气,A与B两者的体积比约为:2:1. 严谨的科学研究态度,善于在实验中发现问题、分析问题,
严谨的科学研究态度,善于在实验中发现问题、分析问题, 近年来,因建设“PX”项目而引发的争议时有发生,PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称对二甲苯,它是一种低毒化合物,毒性略高于酒精.请回答下列问题:
近年来,因建设“PX”项目而引发的争议时有发生,PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称对二甲苯,它是一种低毒化合物,毒性略高于酒精.请回答下列问题: ”代表碳原子,“
”代表碳原子,“ ”代表氢原子.试根据分子模型写出对二甲苯的化学式C8H10.
”代表氢原子.试根据分子模型写出对二甲苯的化学式C8H10.