题目内容
1.写出下列化学方程式(1)二氧化碳与澄清石灰水反应CO2+Ca(OH)2═CaCO3↓+H2O.
(2)碳酸氢钠与稀盐酸反应NaHCO3+HCl═NaCl+H2O+CO2↑.
(3)硫酸钠溶液与硝酸钡溶液反应Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(2)碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑.
(3)硫酸钠溶液与硝酸钡溶液反应生成硫酸钡沉淀和硝酸钠,反应的化学方程式为:Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3.
故答案为:(1)CO2+Ca(OH)2═CaCO3↓+H2O;
(2)NaHCO3+HCl═NaCl+H2O+CO2↑;
(3)Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列物质在氧气中燃烧,产生大量白烟的是( )
| A. | 木炭 | B. | 红磷 | C. | 蜡烛 | D. | 甲烷 |
12.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:
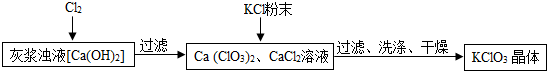
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3 晶体的原因是KClO3在常温下溶解度较小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
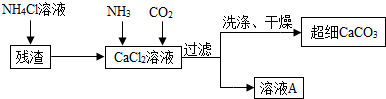
(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
9.HNO3中氮元素的化合价为( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
16.向质量为m克的CaCO3和KHCO3的混合物中,加入质量分数为a%的稀盐酸n克,恰好完全反应后,得到二氧化碳的质量是w克.下列说法正确的是( )
| A. | 混合物中CaCO3和KHCO3的质量比一定是1:1 | |
| B. | 混合物充分反应后,所得溶液的质量是(m+n-w)克 | |
| C. | 混合物中CaCO3和KHCO3无论以任何比例混合,消耗稀盐酸的总质量均为n克 | |
| D. | 混合物中CaCO3和KHCO3无论以任何比例混合,生成二氧化碳的总质量均为w克 |
11.20℃时,将某物质的溶液分成质量相等的两份,其中一份蒸发10g水达到饱和,其二加入3.4g该物质也能达到饱和,20℃时,对该物质的结论正确的是( )
| A. | 溶解度为34g | |
| B. | 是一种易溶物 | |
| C. | 溶质质量分数的最大值为30% | |
| D. | 若要使20℃时饱和溶液的质量分数增大一倍,可采用蒸发溶剂的方法 |
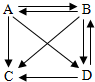 某同学画出的四种物质之间的转化关系图,A、B、C、D代表最常见的含有钠离子的四种物质的溶液,“→”表物质间的转化关系,所有的转化关系都可以通过复分解反应实现.钠离子的符号是Na+,C中溶质的化学式NaNO3 .写出A→B的化学方程式2NaOH+CO2═Na2CO3+H2O;写出D→C的化学方程式NaCl+AgNO3═AgCl↓+NaNO3 .
某同学画出的四种物质之间的转化关系图,A、B、C、D代表最常见的含有钠离子的四种物质的溶液,“→”表物质间的转化关系,所有的转化关系都可以通过复分解反应实现.钠离子的符号是Na+,C中溶质的化学式NaNO3 .写出A→B的化学方程式2NaOH+CO2═Na2CO3+H2O;写出D→C的化学方程式NaCl+AgNO3═AgCl↓+NaNO3 .