题目内容
20.下列四个实验方案设计不合理的是( )| 选项 | 实验目的 | 方案 |
| A | 鉴别硝酸铵和氯化镁 | 取样,分别与熟石灰混合搅拌,闻气味 |
| B | 鉴别空气和呼出的气体 | 用带火星的木条分别伸入集气瓶中,观察现象 |
| C | 除去CaO中的CaCO3 | 高温加热到固体质量不变 |
| D | 除去CuSO4溶液中的H2SO4 | 加过量氧化铜粉末,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 铵盐能和氢氧化钙反应生成有刺激性气味的气体氨气;
氧气能使带火星的木条复燃,当氧气的浓度较小时,不能使带火星的木条复燃;
高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
氧化铜能和稀硫酸反应生成硫酸铜和水.
解答 解:A、取样,分别与熟石灰混合搅拌,无明显现象的是氯化镁,产生刺激性气味气体的是硝酸铵,该选项设计合理;
B、空气和呼出的气体中氧气的浓度较小,都不能使带火星的木条复燃,因此不能用带火星的木条鉴别空气和呼出的气体,该选项设计不合理;
C、高温加热碳酸钙到固体质量不变时,碳酸钙完全分解生成氧化钙和二氧化碳,剩余固体全部是氧化钙,因此可以用高温加热的方法除去氧化钙中的碳酸钙,该选项设计合理;
D、加过量氧化铜粉末,氧化铜和稀硫酸反应生成硫酸铜和水,过滤能够除去过量的氧化铜,剩余溶液是硫酸铜溶液,因此可以用加过量氧化铜粉末,过滤的方法除去硫酸铜溶液中的硫酸,该选项设计合理.
故选:B.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
3.下列对有关燃烧及灭火事例的解释错误的是( )
| A. | 用嘴吹燃着的蜡烛,蜡烛熄灭一隔绝了氧气 | |
| B. | 相同条件下,80℃时白磷能燃烧而红磷不能一白磷的着火点比红磷低 | |
| C. | 炒菜时油锅着火,用锅盖盖灭一隔绝了空气 | |
| D. | 酒精洒到实验台上着火,用湿布覆盖一隔绝空气又降低了温度 |
15.八月桂花开,香气四溢,产生这种现象的原因是( )
| A. | 分子不断运动 | B. | 分子间有间隙 | C. | 分子分成原子 | D. | 分子体积很小 |
12.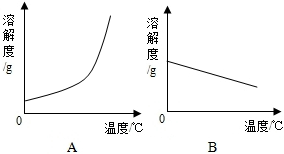 如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
(1)依据如表数据,绘制Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是A(填A或B).
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为9.1g.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙<甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
 如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:
如表是Ca(OH)2和NaOH的溶解度数据,请回答下列问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.
其中措施正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为9.1g.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙<甲(填“>”、“<”或“=”).
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
10.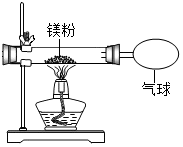 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
(1)小明发现燃烧产物的质量大干反应物镁条的质量,产生这一现象的原因空气中的氧气参加了化学反应.
(2)于是小明同学按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体.
③氮化镁可与水剧烈反应生成氨气,该气体能使湿润的红色石蕊试纸变蓝.
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想
[反思与交流]空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的Mg0却远多于Mg3N2,为什么呢?请给出合理的解释氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应.
(4)该兴趣小组又做了镁条与盐溶液反应的实验.发现均能产生H2.实验现象如表:
如表中,用水进行实验目的是对比.
根据如表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率 ②温度改变反应速率,因为升高温度可以加快产生气体的速率 ③升高温度能使反应更复杂,因为升高温度使镁与水反应的生成物在与盐反应生成氨气(NH3).
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)小明发现燃烧产物的质量大干反应物镁条的质量,产生这一现象的原因空气中的氧气参加了化学反应.
(2)于是小明同学按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
[提出问题]黄色固体是什么呢?
[查阅资料]①氧化镁为白色固体,
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体.
③氮化镁可与水剧烈反应生成氨气,该气体能使湿润的红色石蕊试纸变蓝.
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想
| 实验操作 | 实验现象及结论 |
(4)该兴趣小组又做了镁条与盐溶液反应的实验.发现均能产生H2.实验现象如表:
实验序号 | 实验1 | 实验2 | 实验3 | / |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
根据如表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率 ②温度改变反应速率,因为升高温度可以加快产生气体的速率 ③升高温度能使反应更复杂,因为升高温度使镁与水反应的生成物在与盐反应生成氨气(NH3).

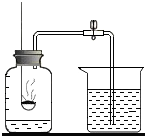 用如图的装置来测定空气中氧气含量,根据实验回答下列问题:
用如图的装置来测定空气中氧气含量,根据实验回答下列问题: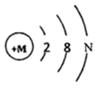 如图是某粒子的结构示意图.当M-N<10时,该 粒子属于阴离子(填“原子”“阴离子“或“阳离子“):该粒子带有2个单位的负电荷,则该粒子的符号是S2-.
如图是某粒子的结构示意图.当M-N<10时,该 粒子属于阴离子(填“原子”“阴离子“或“阳离子“):该粒子带有2个单位的负电荷,则该粒子的符号是S2-.